I Lancet redovisar forskare hur vaccineringen signifikant kunnat reducera antalet fall av SARS-CoV-2 och COVID-19 i Israel redan efter första dosen.
• Samtidigt som en ny beräkning visar att vaccinet kan ha >90% effekt efter en 1:a dos.
• Därtill tyder nya cellbaserade (in vitro-) studier i NEJM att Pfizers och Modernas vaccin tycks ha sämre effekt mot den sydafrikanska varianten B.1.351.
• En av mutationerna i B.1.351, E484K, kan plockas upp av varianten B.1.1.7, medan andra varianter såsom B.1.525 har uppstått, dock av oklar signifikans (en finsk variant undgår i stället upptäckt av en av PCR-testen).
1) Bekräftad reduktion av antalet fall av SARS-CoV-2 & COVID-19 i Israel, nu publicerat i The Lancet
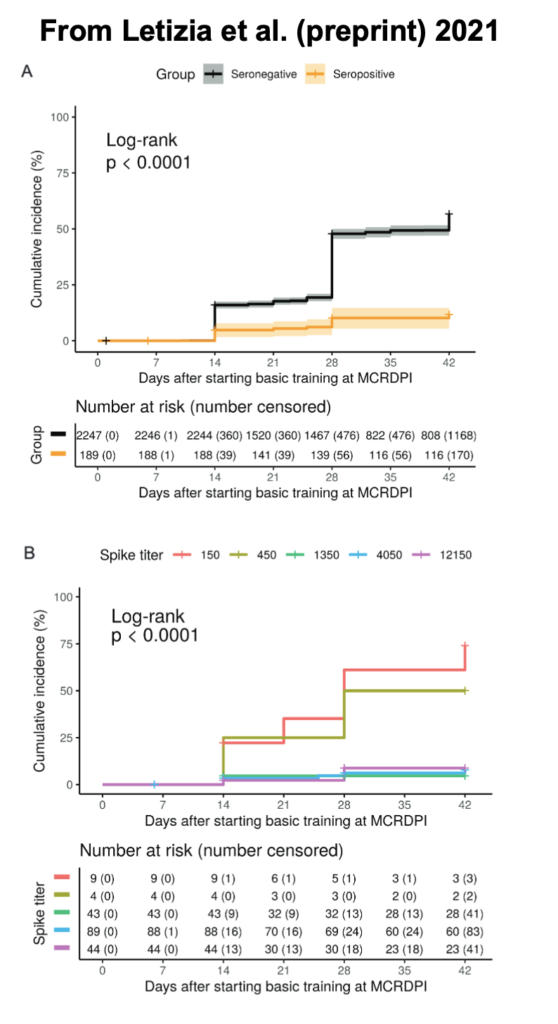
Nu har de första resultaten om en effekt av vaccinering i Israel kommit ut i publicerad form, här i The Lancet. Detta är baserat på 9109 sjukvårdsarbetare som undersöktes, varav 79% hade fått en första dos; 66% en andra dos. Datan här avser alltså effekten av en dos:
-
De såg sen 170 infektioner med SARS-CoV-2 bland de följda deltagarna (8.4/10 000 persondagar).
-
För positiv SARS-CoV-2 (dvs. PCR-bekräftad infektion) finner de en 30% reduktion dag 1-14, och en 75% reduktion dag 15-28, räknat från 1:a dosen. Detta innefattar bl.a. asymptomatiska infektioner men de delade inte in infektionerna efter denna status (ev. för få fall för statistiskt säkra beräkningar). De testade dock inte brett för asymptomatisk smitta, så de kan ha missat sådana fall (se tabellen i övre vänstra delen av figuren nedan)
-
De finner för symptomatisk COVID-19 en 47% reducerad risk dag 1-14, och 85% reduktion dag 15-28, efter 1:a dosen.
-
Notera att man återigen givetvis inte skulle kunna göra denna beräkning ifall man trodde att PCR-test inte funkade (se mitt tidigare inlägg i läkargruppen här)
- Tråden om Lancet-studien här.
2) Hög effektivitet beräknad redan efter en dos av Pfizers vaccin
Samtidigt har man i New England Journal of Medicine (NEJM) beräknat att Pfizers vaccin – liksom för Modernas – egentligen har runt 92% effektivitet i skyddet mot symptomatisk COVID-19, redan 2 veckor efter 1:a dosen. (se nedre tabellen i figuren nedan)
-
Författarna har för denna beräkning använt data som Pfizer skickade in till amerikanska FDA (deras folkhälsomyndighet).
-
Författarna argumenterar att den höga effektiviteten i skyddet mot COVID-19 redan efter en dos bör göra att man överväger att vaccinera fler inom en kortare tidsrymd, i stället för att prioritera att fler får bägge doser inom det hittills studerade 3-veckorsintervallet. Mer om det nedan.
-
Detta skydd skiljer sig från effekten ovan som rapporterats i The Lancet från Israel, där man dock har prioriterat vaccination av de i gruppen 60+. Dock avser ju ovanstående sjukvårdsarbetare (men supplementära filen går inte att komma åt, där man antagligen kan läsa om åldersfördelningen osv.)
-
Samtidigt har CDC nyligen varnat för att man även ska vara vaksam för COVID-19 hos just sjukvårdsarbetare i samband med vaccinationen (dvs. innan vaccinet hinner skydda mot infektionssjukdomen). Detta för att t.ex. inte missta sjukdomen för vaccinbiverkningar och riskera fördröja ev. behandling och isolering, särskilt för riskutsatta sjukvårdsarbetare. Lika oroande är det att en del sjukvårdsarbetare i Israel inte tar vaccinet, och då har blivit sjuka (rapport här).
3) “To delay or not to delay”, dos nummer 2
Samtidigt har läkare i NEJM skrivit två olika argumenterande brev för olika vaccinationsstrategier (länk här):
Dr. Lurie argumenterar för att följa standarddoseringen:
-
Detta utifrån att immunförsvaret antagligen är inkomplett efter 1:a dosen och det är okänt hur ett ändrat dosintervall påverkar immuniteten hos de mest sårbara, äldre individerna. Därtill behöver sjukvårdsarbetare känna sig trygga med att skyddet de får är så bra som möjligt, utifrån ett vetenskapligt säkerställt mått. Att försena dos 2 säger Dr. Lurie kan påverka allmänhetens tilltro till de vetenskapliga utvärderingarna av vaccinen.
-
Därtill lyfter Dr. Lurie att något försämrad (sub-)immunitet i befolkningen kan göra att de nya varianterna selekteras (“selection of antigenic variants that could escape current vaccines”)”
-
Dr. Lurie lyfter även att strikta samhällsåtgärder samtidigt fortsatt kan användas för att bromsa smittspridningen tills vi har hunnit vaccinera tillräckligt många.
Dr. Wachter argumenterar i stället för att fördröja dos nr. 2:
-
Han lyfter att vaccinen är begränsade och delas ut långsamt, samtidigt som varianterna breder ut sig.
-
Han anser att avvikelser från de publicerade studieprotokollen inte är ovetenskapligt, utifrån att studiedata visar att redan 10 dagar efter dos 1 sågs avvikelser i vaccinens effekt kontra placebo.
-
Han lyfter CDCs bedömning att de nya varianterna kan öka smittspridningen i USA kraftigt i USA inom veckor (se mer här).
-
Han tycker att man kan informera befolkningen om en ändrad strategi för att undvika misstro. Han tycker vidare att risken för ökat utveckling av varianter är svår att värdera (dvs. den pga. subimmunitet med en dos), och att man fort bör studera hur effektivt skydd en dos ger (lite som Lancet-studien ovan, under punkt 1).
-
CDC har sagt att man kan vänta upp till 6 veckor med dos 2 av Pfizers vaccin, men uppmanar ändå att ta dem så nära inpå det tänkta intervallet (3 veckor för Pfizer; 4 för Moderna) som möjligt (länk här).
4) Reduktion av skyddet från Pfizers och Modernas vaccin mot sydafrikanska varianten (B.1.351) i cellstudier-studier i NEJM
I New England Journal of Medicine har både Moderna och Pfizer nu även publicerat data som indikerar att deras vaccin (mRNA-1273 respektive BNT162b2) är mindre effektiva mot den “sydafrikanska” varianten av SARS-CoV-2 (B.1.351).
-
Jämfört med vildtyps-SARS-CoV-2 (Wuhan-Hu-1-isolatet) så hade Modernas vaccin en 2.7-6.4-faldig reduktion i neutraliserande titer mot B.1.351 (studien här)
-
Pfizers vaccin hade runt 2/3 reduktion i neutraliserande effekt (titern var 501 för referensvarianten, samt 331 och 184 mot olika versioner av B.1.351) (studien här). Dessa två fynd är ungefär i paritet med de preprints som tidigare rapporterades.
-
Bägge vaccin har emellertid därmed kvar skyddande effekt. Skyddet baseras enbart på in vitro-studier här, dvs. från antikroppar i blod från vaccinerade individer. Därmed kan man inte översätta det till det kliniska skyddet (som även kan inkludera T-cellsskydd; se t.ex. denna preprint).
-
Modernas vaccin testades utifrån blod taget 1 vecka efter den 2:a dosen (därmed möjligt att svaret skulle kunna vara bättre lite senare, men Moderna ger ju ett högt skydd ganska snabbt, se ovan) (se övre högra bilden)
-
Pfizers vaccin testades utifrån blod taget 2-4 veckor efter den 2:a dosen (se nedre högra bilden).
Både Novavax och J&J har för övrigt rapporterat att deras vaccin skyddar mot sydafrikanska varianterna (inlägg i läkargruppen, samt här). Eftersom Pfizers och Modernas vaccin har mycket högt skydd mot symptomatisk COVID-19, är det därmed även troligt att de också uppvisar ett betydande skydd mot symptomatisk COVID-19 av varianten B.1.351.
4.2) Sydafrikanska varianten i Sverige och ev. inverkan på vaccinprioritering?
Den sydafrikanska varianten har nu återfunnits i ett kluster i Sverige (tråd). Bred utbredning av denna variant i Frankrike har lett till att man även från hälsomyndighetshåll (länk) ställer sig frågande till om sjukvårdspersonalen ska vaccineras med AstraZenecas vaccin, då det saknar effekt mot mild till måttlig COVID-19 orsakad av den sydafrikanska varianten av SARS-CoV-2 (länk). Även svenska forskare – här i en artikel med Tove Fall – har nu öppet lyft frågan till diskussion, liknande den som förs i Frankrike.
4.3) Effekten av mutationen E484K – snart kanske en del av B.1.1.7
Samtidigt visar en ny preprint att en av de monoklonala antikroppar som används som terapi vid COVID-19 – Bamlanivimab – förlorar effekt mot den sydafrikanska och brasilianska (501Y.V3, P.1) varianten:
-
De finner även att deras studerade variant med mutationerna K417N, E484K och N501Y) binder till ACE2 bättre.
-
Som de belyser i denna preprint tycks alla monoklonaler (Bamlanivimab, casirivimab, andimdevimab) vara inriktade mot RBD på Spike-proteinet, och har därmed risk att inte verka lika effektivt mot varianter med RBD-mutationer.
-
Mutationen E484K kan också uppstå i den brittiska varianten, och tycks då även försämra hur Pfizers vaccin verkar (in vitro åtminstone, preprint här). Här en beskrivning av Public Health England om hur ofta de har upptäckt B.1.1.7 (som de själva kallar VOC) med mutationen E484K (länk). De har sett mutationen E484K i 11 av 214,159 sekvenserade prover, inkluderar dock alla varianter; men de antyder att den kan ha uppstått flera gången i B.1.1.7)
-
En av preprint-studierna kring effekten av enskilda mutationer (bl.a. E484K) har också publicerats i Nature Medicine (länk), av Texas-forskare. Utifrån studien i Nature Medicine tycks det inte som att den enskilda mutationen E484K behöver medföra så stor förändring i neutralisationsförmågan av t.ex. Pfizers vaccin (här en 20% reduktion baserat på antikroppar i sera), men detta är baserat på enskilda eller kombinationer av några få mutationer i de studerade virusversionerna, in vitro.
-
Preprint-studien som även nämnts ovan antyder en större inverkan på Pfizer vaccin-inducerade antikroppar (länk). Den större inverkan i den senare studien beror antagligen på att de har haft samtliga mutationer i B.1.1.7 på spike-proteinet, samt då även testat att lägga till mutationen E484K (det stämmer även med de NEJM-studier som beskrivs under punkt 4).
5) Ny variant (B.1.525) med oklar betydelse upptäckt, med spridning i flera länder
Flera nya varianter av viruset SARS-CoV-2 har rapporterats på sistone. En av de nyare benämns B.1.525. Den är dock av osäker klinisk signifikans (man vet inte heller om den sprids lättare). Dock visar spridningsmönstret hur snabbt såna här varianter kan breda ut sig globalt sett (se bilden här).
-
B.1.525 har mutationen E484K som har kopplats till ev. försämrad antikroppseffekt (sannolikt ffa. i kombination med andra mutationer).
-
Varianten B.1.525 har även deletionen 69-70 i spike-proteinet. Denna gör som bekant det möjligt att få urskilja såna här varianter, genom att de inte syns på qPCR som använder primers för S-genen (S gene target failure; SGTF eller “S gene dropout”). Samtidigt har det nu rapporterats om en variant som helt kan undgå detektion av N-genen (N gene target failure), i Finland.
-
Varianten B.1.525 har även en annan mutation i spikeproteinet (Q677P) som delas av flera varianter globalt sett. Denna utmärkta tråd belyser hur sådana här förändringar (liksom kanske E484K) kan vara mutationer som viruset uppvisar i s.k. “konvergent evolution” (se här; och här). Dvs. sådana mutationer gör att viruset lättare sprider sig, och uppstår då betydligt oftare slumpmässigt på flera platser globalt sett, oberoende av respektive varandra.
-
B.1.525 har upptäckts i bl.a. Danmark (55 fall beskrivet här), Finland (se bilden ovan), precis nyligen i Norge och även i USA.
Slutligen en bra sammanställning av biverkningarna av vaccinen, med länk här. Den kanske kompletterar min tidigare, som ligger uppe här.
Edits för lite korrigerade hänvisningar/länkar. Trevlig helg!
Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD/senior forskare