- Nya studier som visar på försämrat vaccinsvar mot bl.a. asymptomatisk infektion med Delta-varianten (asymptomatiska infektioner bedöms vara viktiga för att kontrollera smittspridningen). Enligt två nya studier tycks Moderna ha en mer bevarad effekt än t.ex. Pfizers vaccin mot Delta-varianten (ev. pga. att Moderna levererar 100 µg per dos, Pfizer-BioNTech 30 µg per dos)
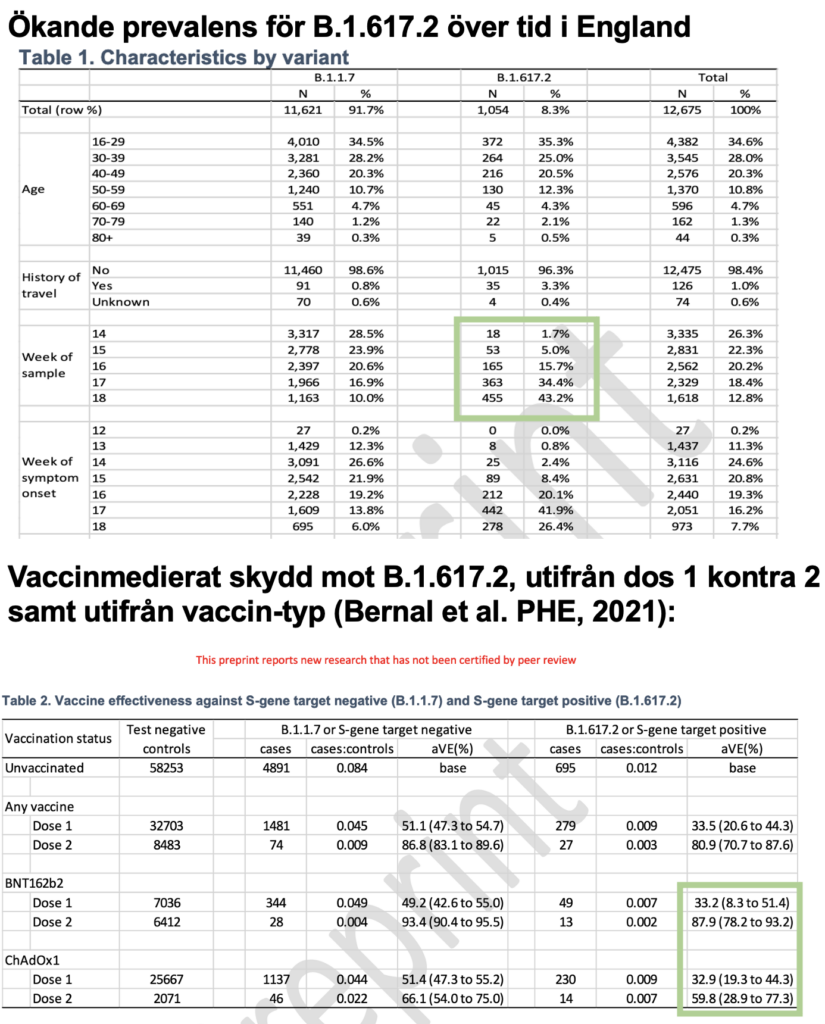
- Data från Public Health England som visar på signifikant ökad reinfektionsrisk med Delta-varianten, för de med tidigare COVID-19 (i enlighet med in vitro-baserad data i t.ex. Nature och New England Journal of Medicine) (se punkt 5 nedan).
- Därtill visar preliminär data på att Delta-varianten gör att virusnivåerna ökar ännu tidigare före symptomdebut än tidigare – det vill säga mer presymptomatisk smitta. Därmed beräknas nära 3 av 4 fall smittas innan de utvecklar symptom.
1. Tidigare SARS-CoV-2-infektion ger ett mer påtagligt svar på första vaccindosen
-
En tidigare studie i Science av Reynolds et al visar god effekt både på T- och B-cellssidan vid en enskild vaccindos hos de med tidigare SARS-CoV-2-infektion. Effekten var påtagligare på antikroppssidan (140 gånger ökning av RBD-antikroppar, 63 gånger ökning av antikroppsutsöndrande celler) jämfört med T-cellssidan (fyrfaldig ökning).
-
Studien av Reynolds et al. visade också att antikroppstitrarna var betydligt högre mot varianterna B.1.1.7 (alpha) och B.1.351 (beta) hos de med tidigare COVID-19 som också hade fått en vaccindos (delta ej undersökt) (se figur 2A i deras artikel, samt skärmdumpen nedan).
-
I frånvaro av tidigare COVID-19 är det i stället boosterdosen som ger ett markant T-cellssvar, som är interferon-inriktat. Detta utifrån en relativt ny singelcells-analys efter en och två vaccindoser (kort sammanfattning här, studien i Nature här)
-
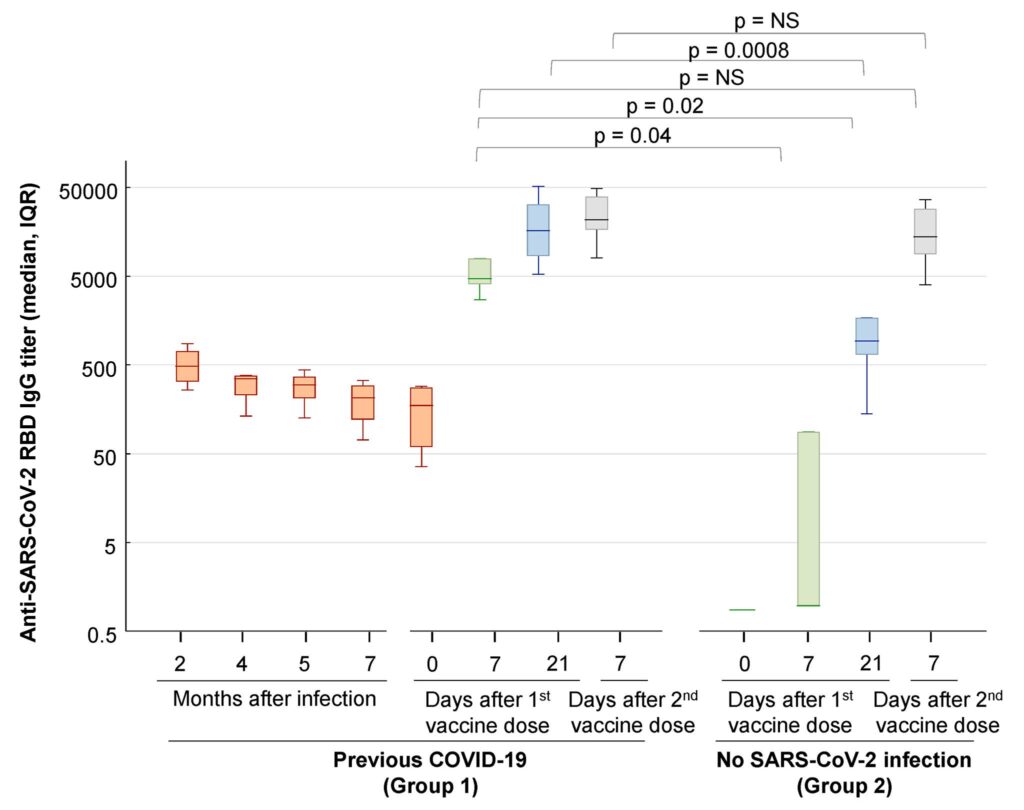
Än fler studier finns – inte oväntat för de som görs för vaccin – på antikroppssidan: Där ser man också att den andra dosen hos tidigare SARS-CoV-2-infekterade ger ett svar som är likvärdigt (och i många fall till synes bättre) än det som ses hos tidigare oexponerade individer som erhållit två doser. T.ex. Gobbi et al. visade att 7 dagar efter dos 1, så har de med tidigare SARS-CoV-2-infektion lika höga antikroppsnivåer som oexponerade individer har 7 dagar efter dos 2
-
Anichini et al. rapporterade nyligen flera intressanta fynd i New England Journal of Medicine:
-
Nivåer av anti-Spike IgG var likartade mellan de med tidigare SARSCoV2-infektion som vaccinerats med en dos (~20,120 AU/mL) och oexponerade som vaccinerats med två doser (~22,639 AU/mL). Dvs. vid säkerställd COVID-19 var en dos i princip återigen minst lika bra som två doser (utifrån dessa analyser).
-
Två intressanta skillnader var a) här för neutraliserande antikroppar, där de med tidigare SARSCoV2-infektion som vaccinerats med en dos hade en titer på ~569, jämfört med ~118 för oexponerade som fått bägge doser. Därtill såg de
-
b) en viss antydan till att längre intervall mellan COVID-19 och vaccindos ett gav ett bättre neutraliserande antikroppssvar (~437 vid 1-2 mån intervall, till ~694 >3 mån intervall).
-
Denna studie byggde på 100 sjukvårdsarbetare, varav 38 hade haft COVID-19.
-
-
I Nature Medicine rapporterade Ebinger et al. om hur 35 sjukvårdsarbetare med tidigare SARSCoV2-infektion uppvisade ett liknande antikroppssvar (anti-S-RBD) som 228 icke-exponerade sjukvårdsarbetare som fått två doser av Pfizers vaccin. De fann även detta med en annan metod (inhibering av ACE2-inbindning) som korrelerar väl med anti-S-RBD-analysen.
-
Liksom en tidigare studie av Krammer et al. i NEJM (som jag beskrivit tidigare här) fann Ebinger et al att biverkningarna var mer påtagliga efter dos ett hos de med tidigare SARSCoV2-infektion. Det stämmer även med den meta-analys som jag beskrivit tidigare (se sammanfattningen här).
-
På antikroppssidan hade Krammer et al. en tidsmässigt högupplöst studie av hur fort de med med tidigare SARSCoV2-infektion utvecklade höga nivåer av antikroppar efter en första vaccindos. Medan de tidigare oexponerade med fortfarande hade runt en AUC ~440 dag 9-12, så hade de med tidigare SARSCoV2-infektion en nivå på ~20800 samma antal dagar efter första vaccindosen. Sammantaget sågs 10-45 gånger högre vaccintitrar efter vaccinering hos de med kontra utan tidigare SARSCoV2-infektion.
1.1. Om man i stället studerar immuniteten över tid efter genomgången COVID-19 / SARS-CoV-2-infektion tycks det – som även sammanfattades överst i detta inlägg – att den ofta är variabel, delvis beroende på infektionens/sjukdomens svårighetsgrad.
En relevant punkt i detta sammanhang är att jämfört med genomgången COVID-19 har nivåerna av antikroppar ofta rapporterats vara högre (eller i det övre intervallet) efter COVID-19-vaccinering jämfört med efter infektionen (uppdatering: Detta stöds även av en ny omfattande preprintanalys av Israel et al.). Detta tycks särskilt vara fallet med mRNA-vaccin som Moderna och Pfizer, samt särskilt i jämförelse med mild och asymptomatisk COVID-19.
1.2. Bland de med tidigare SARS-CoV-2-infektion tycks en betydande andel faktiskt inte alls har en särskild god utveckling eller bibehållande av antikroppar (antikroppskinetik) med tiden. Det vill säga att en stor andel uppvisar antingen ett uteblivet svar tidigt, eller får senare en kraftig nedgång i de antikroppar som vi nu i princip vet (enligt punkt 6 nedan) är ett korrelat för nivån på skyddet mot [re]infektion med COVID-19 (utifrån denna, denna, denna och denna studie).
1.3. Utöver att öka antikroppsnivåerna mycket påtagligt — ett korrelat för skydd mot COVID-19, även mot infektion sannolikt genom att t.ex. cirkulera i höga nivåer i slemhinnorna — så ger vaccinen bredare antikroppsepitop i Spikeproteinet. Det vill säga vaccinen täcker fler regioner av möjliga mål för antikropparna att binda in mot. Detta alltså för just för de regioner som vi redan vet har muterat mycket, dvs. i det så kallade Spike-proteinet och dess RBD-region (Spike-proteinet är det virusprotein i SARS-CoV-2 som binder till våra celler). Detta utifrån en relativt ny studie i Science Translational Medicine.
Sammantaget tycks kombinationen av genomgången SARS-CoV-2-infektion (tidigare COVID-19) och vaccinering ge bättre immunologiskt skydd mot framtida eventuella reinfektioner (som många lär riskera, utifrån mycket hög uppskattad smittsamhet för Delta-varianten). En bättre immunitet vid denna kombination “infektion+vaccin” stöds även indirekt från evidensen som tas upp ovan, från separata studier (enligt punkt 1.1-1.3).
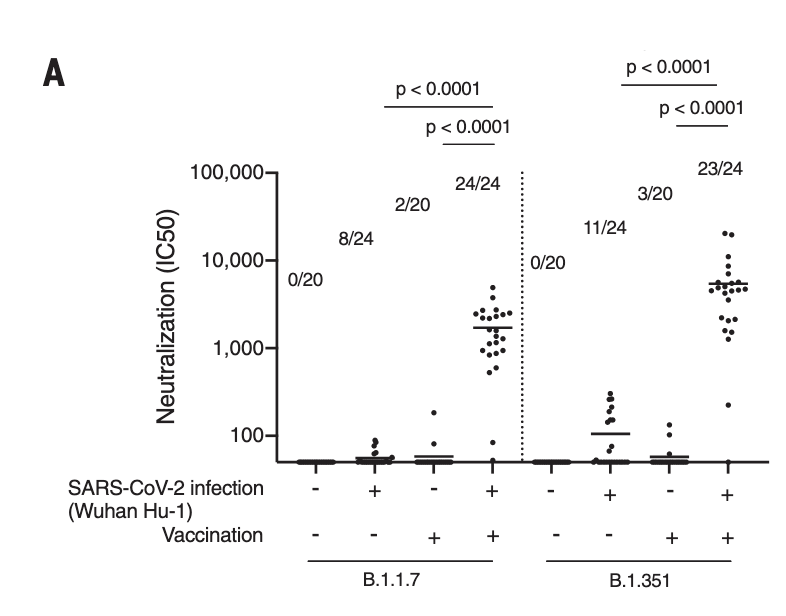
2. Andra dosen av vaccin förbättrar särskilt skyddet mot variants of concern även hos de med tidigare SARS-CoV-2-infektion
-
I den nya studien av Urbanowicz et al., visar forskarna att även hos de med tidigare SARS-CoV-2-infektion så sågs en betydande in vitro-baserad förbättring i skyddet mot Beta-varianten från den andra dosen: I denna grupp ökade den neutraliserande antikroppsnivån (titern) från 1:60 till 1:300 efter boosterdosen (högre värde är bättre i en sådan spädningsbaserad analys).
-
Denna observation skiljer sig dock jämfört andra fynd, som för de med genomgången COVID-19 inte har funnit en avsevärd ökning av immuniteten (in vitro-baserad) från den andra dosen. Alla sådana studier har dock inte studerat skillnader som varianter kan orsaka, exempelvis en variant som Beta, vilken man vet att (nuvarande) vaccinens verkan är sämre mot. Reynolds et al. (se punkt 1 ovan) studerade dock B.1.351 och såg inga ytterligare fördelar med en andra dos vaccin för de med tidigare COVID-19.
-
Huvudlinjen med studien av Urbanowicz et al. – liksom de andra studierna i denna sammanställning kan argumentera för – är att antalet exponeringar för ett antigen ökar förmågan att effektivt neutralisera det och ev. variationer av samma antigen från samma virus (här givetvis SARS-CoV-2). Detta visar Urbanowicz et al. även är fallet mot varianten P.1, där de kunde se att de med tidigare SARS-CoV-2-infektion som vaccinerats med två vaccindoser hade signifikant bättre neutralisering av varianten än de icke-exponerade som erhållit två vaccindoser (se skärmdump från Figur 3 nedan).
-
Intressant nog tyder därtill en del av resultaten att de med tidigare SARS-CoV-2-infektion har ett sämre skydd mot varianten beta (B.1.351) jämfört med fullvaccinerade, tills de har erhållit bägge doser (se Figur 1C sedan).
- Att den andra dosen överlag ger en avsevärd förbättring i skyddet mot COVID-19, för majoriteten icke-tidigare infekterade individer, finns beskrivet i flera av mina tidigare sammanställningar (se t.ex. här och här). Enligt en nyare studie i Nature (läs gärna min tråd här), ger den andra dosen även en påtaglig inducering av det viktiga T-cellsbaserade skyddet, hos de som tidigare inte har haft COVID-19. Detta sker genom en mycket potent aktivering av antivirala signalvägar (interferon) i denna del av det så kallade adaptiva/specifika immunförsvaret.
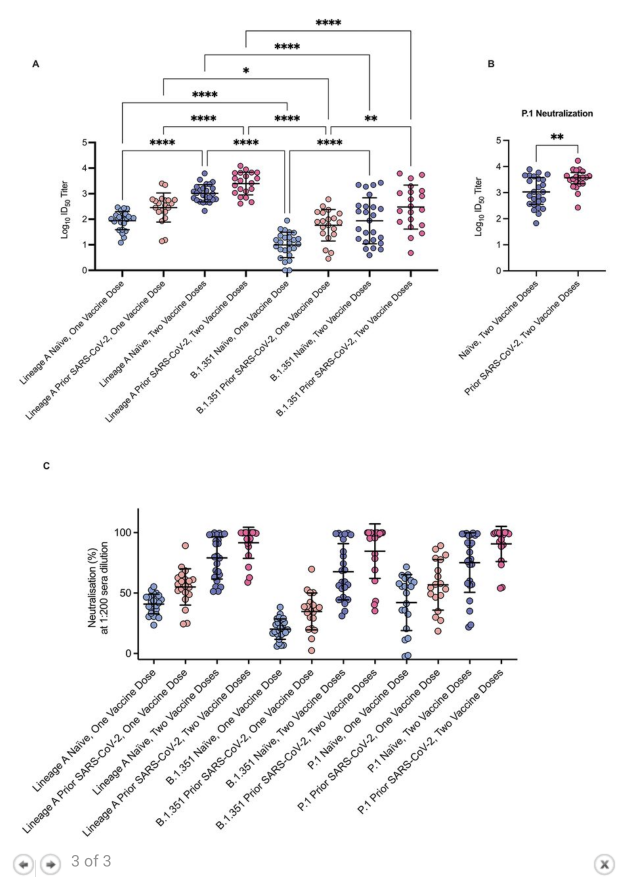
3. COVID-19 efter vaccinering tycks också förbättra det antikroppsbaserade skyddet mot COVID-19
-
I studien presenteras data från 13 som fått två doser vaccin och sen smittades med SARS-CoV-2. De jämfördes med elva något yngre (~82.6 kontra ~85.3 ¨¨¨¨¨¨¨¨år gamla) individer som “bara” hade fått två vaccindoser.
-
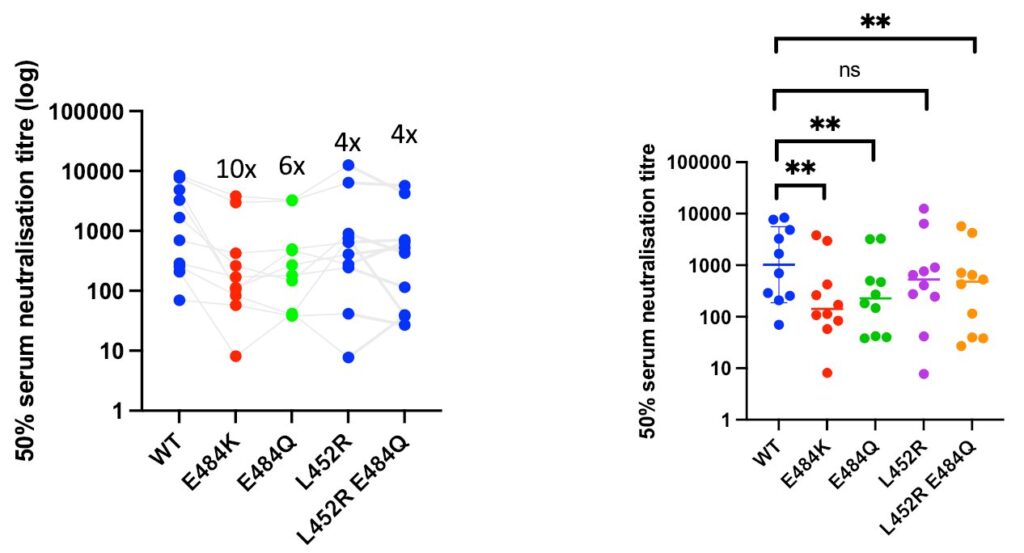
Som ses i figur 2 (screenshot nedan) hade de flesta av de icke-infekterade individerna, bland dessa äldre, knappt någon neutralisering av varianterna alpha (B.1.1.7) och beta (B.1.351).
-
De individer som vaccinerats men som också hade smittats med SARS-CoV-2, hade däremot klart mätbara titrar (~640 mot alpha; ~160 mot beta). Anti-Spike IgG var även betydligt högre hos dessa (~6930 kontra ~270)

4. Lång tid från fullbordad vaccinationsserie kan öka risken för infektion med delta – länder överväger eller ger extradoser
- Detta samtidigt som två preprintstudier (även den andra från Israel) indikerar att de som vaccinerades först i år har sämre skydd mot delta än de som vaccinerades senare:
- I studien av Mizrahi et al., fann de att de som hade vaccinerats i januari-februari – jämfört med mars-april – hade över 50% högre risk för en infektion med Delta-varianten, och detta oavsett ålder. Detta var i en analys som hade justerats för komorbiditeter (t.ex. med tanke på vaccinprioriteringar som förelåg tidigt i pandemin).
- Skillnad i risk var ännu högre när de som vaccinerats i januari jämfördes med de som vaccinerats i april: 126% högre risk för en infektion med Delta-varianten trots vaccinering för den tidigare kontra senare gruppen.
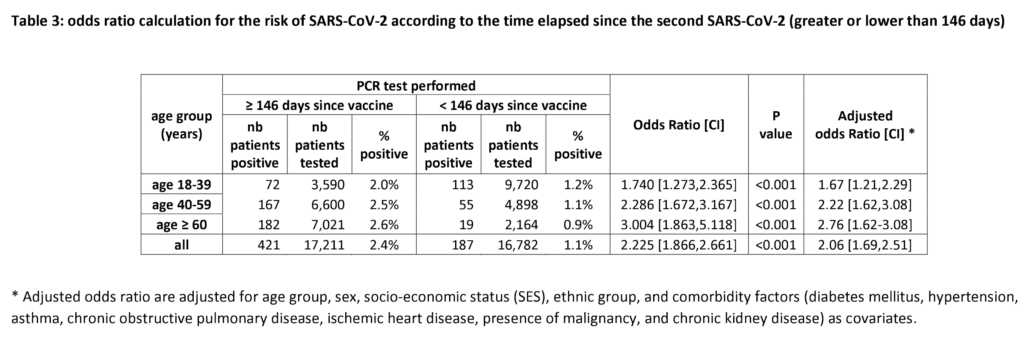
- I den andra preprintstudien av Israel [sic!] et al., fann de att odds-ratiot var 3 gånger högre för SARS-CoV-2-infektion hos de över 60 år som hade vaccinerats för mer än 146 dagar sen, jämfört med de som hade vaccinerats mer nyligen. De såg även sådana signifikanta riskökningar för grupperna 40-59 (odds ratio 2.29) och 18-39 år (odds ratio 1.74). Skillnaden ses även i skärmdumpen av preprintstudiens tabell 3 nedan. För övrigt var 93% av infektionerna de observerade – enligt urvald sekvensering – just Delta-varianten, liksom i studien ovan av Mizrahi et al.
- Dessa preprintdata har lagts upp samtidigt som ny, mer slumpmässigt insamlad, preliminär brittisk data, tyder på att de i Storbritannien använda vaccinen har än sämre skydd mot symptomatisk (~60%) och asymptomatisk (~50%) COVID-19 orsakad av Delta-varianten. i Storbritannien används framförallt AstraZeneca adenovirusvektor-vaccin och Pfizers mRNA-vaccin.
- En del av dessa nyare brittiska data (från REACT1-studien) kan rimligtvis också spekuleras åtminstone delvis bero på lägre antikroppsnivåer hos de som vaccinerades först (Storbritannien började liksom Israel också sin vaccinationskampanj snabbt och tidigt).
5. Delta tycks öka återinfektionsrisken för de med tidigare COVID-19
Enligt ovan beskrivning (punkt 4) kan effekten mot skyddet som vaccin ger avta över tid – åtminstone mot icke-allvarlig COVID-19 orsakad av en nyare variant som delta (enligt mina tidigare sammanställningar ger vaccinen gott skydd åtminstone i närtid mot allvarlig COVID-19 orsakad av Delta-varianten).
Nyligen släppt preliminär observationsdata (från Public Health England) speglar på sätt och vis samma fenomen hos de med tidigare COVID-19. I analysen finner forskarna att de med tidigare SARS-CoV-2-infektion hade nära 50% högre risk för reinfektion med delta (B.1.617.2) kontra med den tidigare dominerande varianten, alpha (B.1.1.7; tidigare kallad den “Brittiska”, eller “Kent”-varianten).
- Forskarna delade även in deltagarna utifrån tid sen vaccinationen: Den förhöjda risken för reinfektion med Delta-varianten sågs vid COVID-19 som inträffat mer än 180 dagar sen, vid denna gräns var risken nära 140% högre (sida 35 i rapporten länkad ovan). Detta är förenligt med liknande mekanismer hos de som vaccinerats en längre jämfört med kortare tid sen (enligt punkt 4 ovan).
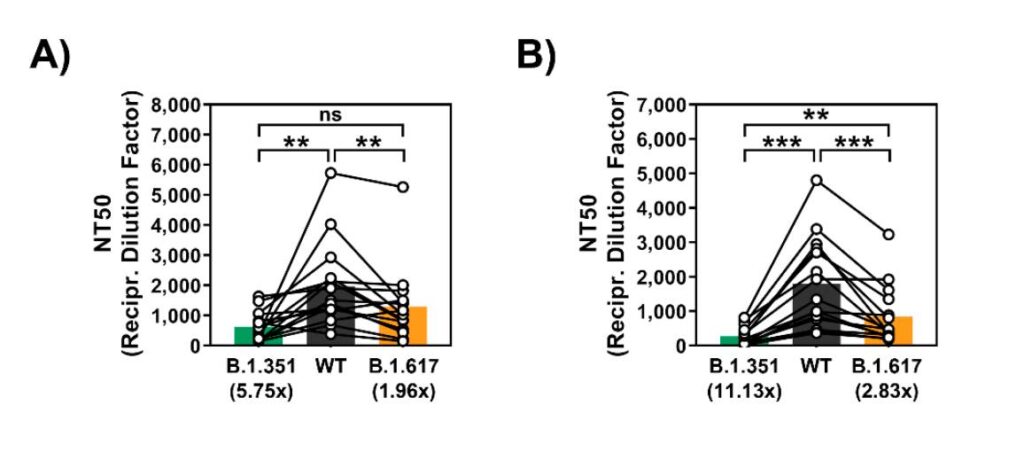
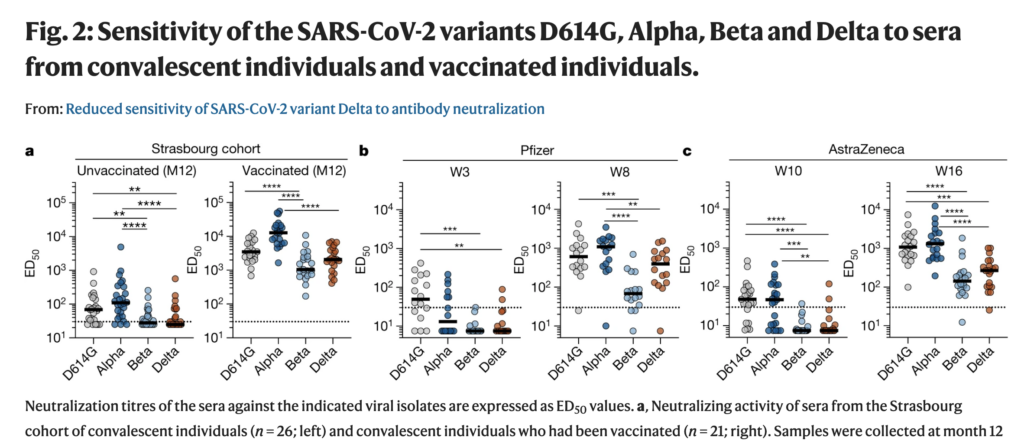
Samtidigt finns det viss in vitro-baserad data som indikerar att varianten Delta-varianten inte reducerar neutraliseringsförmågan av antikroppar efter genomgången COVID-19. Dock tycks alltså datan från Public Health England tyda på förhöjd reinfektionsrisk med Delta-varianten. Samstämmigt med denna data finns det sen tidigare en annan in vitro-baserad studie, av Planas et al. i Nature. De finner att Delta-varianten orsakar en fyrfaldig reduktion i antikroppsaktiviteten, hos individer med genomgången COVID-19.
Liknande resultat – det vill säga försämrad neutralisering av Delta-varianten hos de som tidigare haft COVID-19 – har Liu et al. beskrivit i Cell, samt och Edara et al. i New England Journal of Medicine.
Samtidigt visar studien av Planas et al. i Nature, att de med genomgången COVID-19 som sen vaccinerades, hade en påtagligt förbättrad neutralisering av samtliga testade varianter, dvs. Alpha, Beta och just även Delta (se högra jämfört med vänstra gruppen i panel A i skärmdumpen nedan). Dessa individer vaccinerades som syns nedan med med Pfizer eller AstraZeneca – den förbättrade immunologiska effekten syntes därmed oberoende av vaccin.
Datan som talar för avtagande reellt skydd över tid mot varianten Delta, hos de med genomgången COVID-19, kan därmed också sägas tala för vikten av att vaccinera denna grupp.
6. Korrelat för skydd mot infektion – talar ytterligare för fördelar med vaccinering även vid tidigare COVID-19
Tidigare har man helt saknat en beprövad metod för att kunna översätta nivåer av immunologiska parametrar (såsom nivåer av antikroppar) till en faktisk nivå av skydd mot infektion med SARS-CoV-2 eller olika former av själva sjukdomen COVID-19. Detta har man nu kommit närmare i några studier och preprintanalyser.
För det första har man nyligen i tidskriften Vaccine tittat på de olika vaccinstudierna och funnit korrelat mellan antikroppsnivåerna (för olika vaccin) och skyddet som studierna fann (och då mellan olika geografiska platser, så tycks som ett ganska robust fynd)
För någon månad sen kom en annan studie i Nature Medicine, där forskarna kunde etablera ett mått på vilken nivå av neutraliserande antikroppar som kan motsvara ett faktiskt skydd mot infektion med SARS-CoV-2 (20% av medel-titernivån), samt svår COVID-19 (3% av medel-titernivån, dvs. man behöver högre nivåer av antikroppar för skydd mot infektion än mot svår sjukdom).
De kunde i studien även liksom i andra analyser se att antikroppsnivåerna går ner med tiden efter vaccination – ett förväntat fenomen, beskrivs i t.ex. denna Review. Detta spelar sannolikt även roll för en nedgång över tid för skyddet mot just infektion (t.ex. asymptomatisk infektion) med SARS-CoV-2 i sig – till skillnad för skyddet mot svår COVID-19, som beräknas bibehållas bättre över tid (då minnesceller kan aktiveras vid re-exponering och öka t.ex. antikroppar och då begränsa virusets framfart i kroppen). En nedgång av antikroppsniverna över tid skulle därmed kunna bli en anledning till att eventuellt behöva få extra vaccindoser. Behovet och frekvensen kan givetvis moduleras utifall att eller beroende på vilka eventuella nya varianter som kan börja spridas.
Att en viss nivå av neutraliserande antikroppar är av betydelse för så kallade genombrottsfall (fall där fullvaccinerade ändå infekteras med SARS-CoV-2; “breakthrough cases”) stöds även exempelvis av en analys i New England Journal of Medicine. Där studerade de breakthrough-fall för den tidigare dominerande varianten alpha (B.1.1.7) bland fullt vaccinerade individer. De observerade att de med lägre a) vaccininducerade maxnivåer, och b) nivåer vid själva infektionstillfället, av neutraliserande antikroppar, hade en högre risk för genombrottsfall.
En annan observation från studien ovan var för övrigt just i linje med att nivån av neutraliserande antikroppar mildrar risken för vidareförd smitta sig: De noterade nämligen högre CT-värden hos de med högre nivåer av neutraliserande antikroppar vid själva infektionstillfället. Högre CT-värden vid PCR-testning motsvarar lägre virusnivåer, och sådana lägre nivåer utifrån CT-värden är en parameter som man vet korrelerar med risken att vara smittsam – även för Deltavarianten,
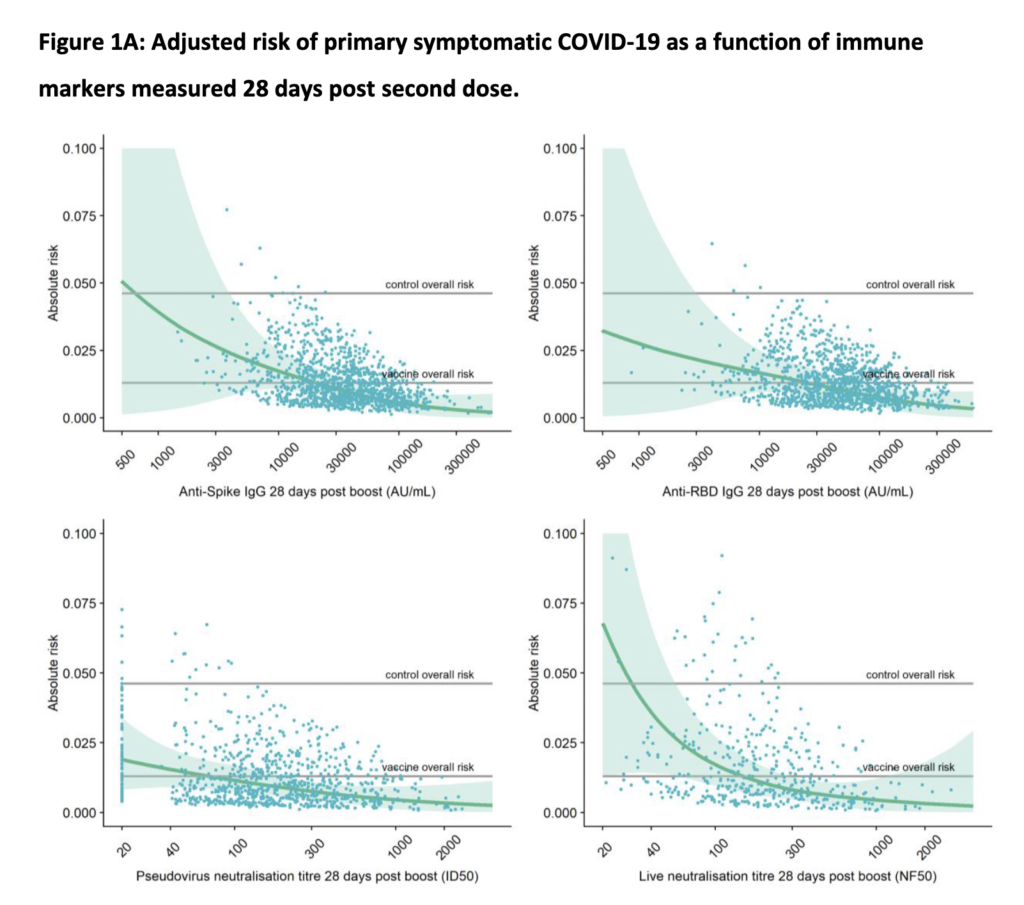
Därtill finns det en ganska stor preprintstudie som också tyder på att nivåer av neutraliserande antikroppar direkt korrelerar med skyddsnivån mot symptomatisk COVID-19 (här ifrån AstraZenecas studie). Det vill säga att ju högre antikroppsnivåerna var av typen IgG mot Spike-proteinet och mot RBD-delen av Spike-proteinet, desto lägre var risken för symptomatisk COVID-19 (se screenshot från figure 1A nedan). Däremot fann de inget korrelat för skyddet mot asymptomatisk infektion, utifrån nivån av sådana antikroppar.
Ovanstående typ av information (in vitro-baserade korrelat för immunitet) kan förhoppningsvis användas för att framgent (i ett första skede, tidigt) kunna beräkna den förmodade skyddseffekten av vaccin, innan man får fram efficacy data. Detta kan t.ex. gälla uppdateringar av COVID-19-vaccinen. Fynden representerar bara estimat för skyddseffekten och utgör ingen definitiv gräns för när man absolut kan räkna med skydd eller frånvaro av skydd ute i samhället.
Liksom man kunde läsa ovan (enligt punkt 4 ovan), kan skyddet därtill gå ner över tid. Detta är ytterligare en anledning till varför sådana beräkningar utifrån antikroppsnivåer bara kan användas för speciella ändamål – potentiellt många variabler måste tas med i beräkningarna. En variabel är t.ex. vilken variant man undersöker mot: I preprintanalysen ovan för AstraZenecas vaccin gällde det alpha (B.1.1.7). Resultaten kan därmed sannolikt skilja sig t.ex. avseende korrelat för skydd mot Delta-varianten.
7. Andra relaterade länkar om bland annat boosterdoser och heterolog prime-boosting:
- I USA förbereder man sig för att ge en 3:e boosterdos till fullvaccinerade individer. Detta bl.a. utifrån data som beskrivs ovan (dvs. att längre tid sen vaccinering skyddar sämre). Läs gärna mer om detta i denna tråd. Som noterat på övriga delar i detta blogginlägg, tycks skyddet som fullbordad vaccination ger mot svår COVID-19 orsakad av Delta-varianten, vara relativt välbevarat (se gärna även mina tidigare inlägg).
- En anledning för varför vissa länder kanske ser sämre vaccinmedierad skyddseffekt mot genombrottsinfektioner orsakade av Delta-varianten, och därmed kan ha ett större behov av boosterdoser för att motverka spridning av Delta-varianten, är att de valde ett kortare intervall mellan dos 1 och 2. Detta intervall var emellertid i enlighet med de ursprungliga fas 3-studierna och fungerade för länder med god tillgång till doser (såsom USA och Israel).
- Ett längre dosintervall tycks dock gynna nivåerna av antikroppar, exempelvis upp till en faktor två enligt en preprintstudie. En annan preprintstudie fann dock ingen skillnad utifrån skillnader i dosintervall, men där kan jämförelsen vara missvisande, då enbart ≥9 och ≤9 veckor intervall jämfördes (kontra USA:s och Israels utbredda användning av framförallt 3-4 veckor dosintervall).
- En låg risk för myokardit som oftast är mild och självbegränsande, har beskrivits för yngre, framförallt unga män efter vaccinering med mRNA-vaccinen mot COVID-19. Risken för sådan vaccinrelaterad myokardit är dock enligt nyare analyser betydligt lägre än risken för myokardit efter COVID-19 hos tonåringar, eller för risken för sjukhuskrävande COVID-19. Se gärna min korta sammanställning här.
- Därtill talar mycket preliminära data för att Delta-varianten ökar risken för sjukhuskrävande COVID-19 hos barn. Om bekräftat skulle det stämma med data för vuxna och skulle med största sannolikhet i så fall skifta denna risk-nyttaanalys ytterligare, mot nyttan av vaccinering av barn.
- Ytterligare data (nu publicerat i the Lancet Respiratory Medicine) talar för att heterolog prime-boost-vaccinering (där man ger olika vaccin för dos 1 kontra 2) är fördelaktigt. Åtminstone in vitro (i labet) gav heterolog vaccinering enligt den nya studien bättre effekt mot varianten beta av SARS-CoV-2. Här gavs AstraZeneca och Pfizer-BioNTechs vaccin i följd, och jämfördes mot två doser av respektive samma vaccinsort.
- Gällande beslutet att ge en boosterdos till fullvaccinerade, har WHO uppmanat länderna att avvakta, då många fattigare länder ännu inte har kunnat vaccinerat sina befolkningar ens med en förstados. Liknande uppmaningar har hörts även från forskare, avseende att ge en andra dos till de med tidigare COVID-19 – utifrån att de redan av en första dos får bra skydd (om man just med säkerhet vet att de tidigare har haft COVID-19). Dock kan den andra dosen, enligt data som presenteras ovan (punkt 2), eventuellt ge fördelar mot nu välspridda varianter såsom Delta.
- Som jag har beskrivit tidigare så tycks de med tidigare COVID-19 generellt sett få högre frekvens av biverkningar vid vaccination mot COVID-19. Dessa biverkningar är dock oftast övergående och hör till det normala spektrat av förväntade biverkningar efter vaccination. Risken för vissa allvarligare biverkningar som eventuellt kan kopplas till vaccinen, är därmed (liksom för fallet med myokardit hos ungdomar ovan), betydligt lägre än risken för motsvarande sjukdomshändelse efter att ha drabbats av COVID-19.
Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD och senior forskare