Vaccination mot COVID-19 sänker virusnivåerna och kortar symptomdurationen vid genombrottsinfektion, och vaccinens (Moderna, Pfizer, AstraZeneca) skydd mot delta-varianten stöds ytterligare av en ny preprintstudie
- En ny studie i NEJM finner liksom tidigare lägre virusmängder (här 40% lägre) hos vaccinerade som smittas, men därtill att de även har kortare symptomduration, lägre risk för & färre dagar med feber/symptom och lägre behov av sängliggande dagar (punkt 1). Lägre virusmängder vid infektion hos vaccinerade stöds av tidigare studier samt av en annan studie i The Lancet Regional Health Europe.
- En översiktsartikel i New England Journal of Medicine (NEJM) diskuterar sen hur man kan tänka kring vaccinationsstrategier för att minska risken för utveckling av nya varianter. T.ex. kan hårt smittade områden prioriteras extra, och så kallade ringvaccination kan övervägas för utsatta individer.
- En ny preprintstudie från Kanada tyder på att Modernas, Pfizers och AstraZenecas vaccin skyddar relativt väl mot svår COVID-19 orsakad av deltavarianten (B.1.617.2) redan efter en dos – men två doser förbättrar skyddet, i enlighet med tidigare studier.
1. Lägre virusmängder & mildare sjukdomsförlopp hos vaccinerade som smittas av SARS-CoV-2
En studie som jag beskrivit tidigare (se punkt 4 i mitt tidigare inlägg) har man i Israelisk data funnit att en dos vaccin gav lägre virusnivåer hos de som ändå smittades av SARS-CoV-2 (beskrivet i mitt tidigare inlägg). En annan sådan studie publicerades senare i Nature Medicine och fann lägre virusnivåer hos vaccinerade individer, räknat dag 12 efter att ha fått en dos av Pfizers vaccin (studielänk).
Nu har amerikanska forskare i New England Journal of Medicine – Thompson et al. – beskrivit liknande fynd men också utifrån symptomdata, hos två prospektiva kohorter (HEROES-RECOVER) av amerikanska sjukvårdsarbetare och utryckningspersonal.
- Kohorterna omfattar ffa. kvinnor (62%) av yngre vuxna (72% i spannet 18-49 år). 31% hade minst en underliggande sjukdom (av de vaccinerade var det 83%, kontra 18% bland de ovaccinerade)
- Deltagare fyllde månadsvis i rapporter om ev. exponering för SARS-CoV-2 och användning av PPE, inklusive munskydd, under de föregående sju dagarna.
- Veckovisa meddelanden undersökte förekomsten av symptom på COVID-19 och vid symptom fick deltagare fylla i information om symptomen, tidsperioden, samt antalet sängliggande dagar. Veckovis lämnade deltagare även näsprov för PCR, ett prov som upprepades tillsammans med salivprov vid symptom på COVID-19
- Det primära utfallet var tid till bekräftad PCR-bekräftad SARS-CoV-2-infektion, med sekundärmåtten viral load (högsta medelvärdet under infektionen), samt duration för febrila symptom och sjukdomsduration hos de med bekräftad infektion. För viral load kombinerades partiella och fullt vaccinerade fall, då antalet PCR-bekräftade infektioner var sammantaget få i kohorten.
- 80% hade fått minst en vaccindos; två tredjedelar hade fått Pfizer; en tredjedel hade fått Moderna.
- Användningen av skyddsutrustning (PPE), andelen som hållit kort avstånd till andra eller haft möjlig exponering för andra med COVID-19, var parametrar som var likartade hos de som vaccinerats/ej vaccinerats, samt hos de som smittades kontra inte smittades, bland studiedeltagarna.
Resultat:
1.1) Skyddseffekt mot COVID-19 hos de olika vaccingrupperna:
- 5 fullvaccinerade, 11 partiellt vaccinerade och 156 ovaccinerade deltagare smittades. Vissa varianter ingick bland dessa få fall, och tycktes vanligare bland de vaccinerade (30%) kontra ovaccinerade (10%). Detta är eventuellt i enlighet med att de vaccinerade är väl skyddade mot tidigare versioner av SARS-CoV-2, och därmed ffa. riskerar drabbas av nyare varianter som bättre kan undgå vaccinen i någon mån. Dock kan det också röra sig om att varianterna blev vanligare med tiden (då alltfler också vaccinerades), i och med att detta var en prospektiv studie.
- Vaccinationseffekten (mot COVID-19) beräknades till 91% med full vaccination och till 81% med partiell vaccination. Här tycks datan deskriptivt vara till Pfizers fördel, men det kan också (liksom när jag beskrev frånvaron av effekt för AstraZenecas vaccin mot beta, B.1.351) bero på att antalet fullt vaccinerade deltagare med Modernas vaccin var så få (770 jämfört med 1731 för Pfizers vaccin).
- Värt att notera är dock att medelvärden var snarartade, att annan data talar snarare till Modernas fördel (t.ex. endosdatan mot Delta, se t.ex. denna preprintstudie som beskrivs nedan under punkt 3); samt att konfidensintervallen överlappar mellan vaccintyperna i NEJM-studien. På samma sätt kan vaccineffekten för partiellt vaccinerade (med i snitt färre (22 kontra 69) observationsdagar) ha lett till mer oprecisa uppskattningar för effekten av en första dos vaccin.
1.2) Effekt av en eller två doser mRNA-vaccin på COVID-19 och dess symptom hos smittade vaccinerade kontra ovaccinerade:
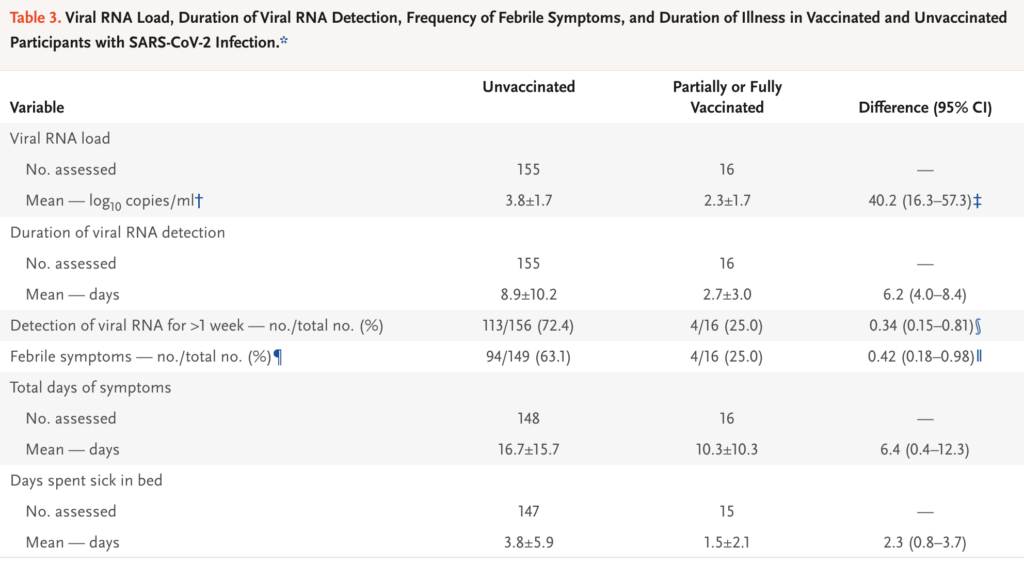
- De som efter partiell eller full vaccinering fick COVID-19, hade 40% lägre viral load (95%-igt konfidensintervall (95%CI): 16.3-57.3) (se skärmdump från tabell 3 nedan, under kolumnen “Difference”)
- 75% av de vaccinerade var PCR-positiva i upp till en vecka, medan 72% av de ovaccinerade i stället var PCR-positiva i över en vecka. De som åtminstone var partiellt vaccinerade hade därmed 66% lägre risk att vara PCR-positiva i över en veckas tid.
- Bara 25% av de partiellt/fullt vaccinerade som smittades hade febrila symptom, kontra 63% av de ovaccinerade (58% lägre risk)
- Antalet symptomatiska dagar vid smitta var 6.4 färre (95%CI 0.4-12.3), med 2.3 färre sjukhusbundna sådana, hos de partiellt eller fullt vaccinerade, jämfört med ovaccinerade.
- I och med att den undersökta perioden är fram till april 10, 2021, finns ingen information om effekten på varianter som Delta, och antalet fall av varianter av SARS-CoV-2 var sammantaget få. Däremot har tidigare studier, fast inte alla, ganska tidigt funnit att t.ex. alpha (B.1.1.7) medför högre virusmängder (även om den absoluta nivån tycks variera beroende på studie).
- En ny studie i “The Lancet Regional Health – Europe”, av Regev-Yochay et al., finner också liknande fynd gällande virusmängderna hos vaccinerade jämfört med ovaccinerade individer. I detta fall rör det sig om en kohort på nära 10 000 sjukhuspersonal, i en population som uteslutande hade använt Pfizers mRNA-vaccin mot COVID-19, BNT162b2 (även kallat Comirnaty):
- Fynden tydde på att förekomsten av symptomatiska och de viktiga smittsamt symptomatiska individer var nära 90% lägre hos fullt vaccinerade jämfört med icke-vaccinerade individer.
- Skyddet mot asymptomatiska infektioner (“never-symptomatic SARS-CoV-2 infections”) var 83% hos fullt vaccinerade jämfört med icke-vaccinerade individer.
- Därtill var de så kallade CT-värdena – där högre tal betyder lägre mängd funnet virus – signifikant högre hos fullt vaccinerade jämfört med icke-vaccinerade individer (~27 vs. ~22). Dvs. virusmängderna hos de som var vaccinerade men ändå smittades, var betydligt lägre. Detta ger även viruset färre möjligheter att mutera, till potentiellt nyare varianter, ifall man infekteras.
- De flesta som ingick i denna studie var i åldersspannet 18-45, så skyddseffekten kan vara lägre för andra ålderskategorier (och tycks därtill eventuellt gå ner över tid, åtminstone hos äldre individer som på grund av biologiska skäl har ett sämre immunförsvar).
Ovanstående fynd kan vara av betydelse bl.a. för risken för sekundärsmitta, ifall man exponeras för en [vaccinerad] individ som smittats med SARS-CoV-2 (se t.ex. denna spanska studie i The Lancet Infectious diseases, beskriven under punkt 2 i mitt tidigare inlägg). Tidigare studier har mycket riktigt också funnit att vaccinering ger ett indirekt skydd t.ex. yngre individer i omgivningen (inlägg om detta här). Sådant indirekt skydd har uppskattats även för hushållsmiljöer, med tilltagande skydd med tid efter dosen (preprintstudie här).
Notera att det indirekta skyddet av nu använda COVID-19-vaccin eventuellt relativt sett kan vara försämrat, i och med den dominerande spridningen av den mer smittsamma varianten delta (B.1.617.2). Denna variant har i preliminära data beskrivits vara mer smittsam bl.a. genom en kombination av högre virusmängder och kortare intervall mellan smitta och den ökande, smittsamma virala fasen. I sammanhanget är det värt att notera att virusmängderna enligt flera tidigare studier är som högst i slutet av den presymptomatiska fasen (som enligt flera studier dominerar för smittspridningen, bl.a. enligt denna meta-analys).
Viral load är även kopplat till allvarlighetsgrad på COVID-19 (studie i Nature Communications här) – vaccinen skyddar som känt mycket väl mot allvarlig COVID-19. Men man kan även spekulera att de nya fynden kan vara av betydelse för att påverka fördelningen av presymptomatisk/asymptomatisk kontra symptomatisk smitta, samt ev. risken för långtidscovid vid [allvarligare] genombrottsfall.
2. NEJM-artikel om vaccinationsstrategier för att motverka varianter av SARS-CoV-2
I tidskriften New England Journal of Medicine har Krause et al. skrivit en kortare sammanfattning om möjliga strategier för att motverka utvecklingen av nya smittsammare varianter av SARS-CoV-2.
- Artikeln beskriver hur vaccinen ännu har kvar sin viktigaste effekt mot nuvarande varianter, dvs. skyddet mot allvarlig COVID-19. Artikeln går igenom hur man kan fortsätta att designa randomiserade vaccinstudier (t.ex. med ett existerande vaccin som kontrollgrupp). De föreslår att ev. kunna fortsätta med placebo-kontrollgrupper hos de där risken för allvarlig sjukdom är låg (t.ex. bland yngre individer)
- För att undvika utvecklingen av nya varianter påpekar det att det är extremt viktigt att hålla smittspridningen nere, detta i kombination med smittskyddsåtgärder som att hålla avstånd och använda munskydd.
- På denna punkt anger de även att en strategi kan vara att vaccinera områden med hög smittspridning, eller s.k. ringvaccinering kring känsliga individer. T.ex. kan vissa vaccin kanske komma att fungera som post-expositionsprofylax och då kan sådan inriktning vara fördelaktig när vaccintillgången är begränsad (som den globalt sett ser ut att vara några år framåt).
- Möjligen kan vaccin som inriktas på slemhinnemedierad (IgA-) immunitet ge oss sådana möjligheter: t.ex. Vaxarts orala vaccin, eller intranasala vaccin. Slemhinnemedierad immunitet tros nämligen vara särskilt viktig för att kunna reducera transmission.
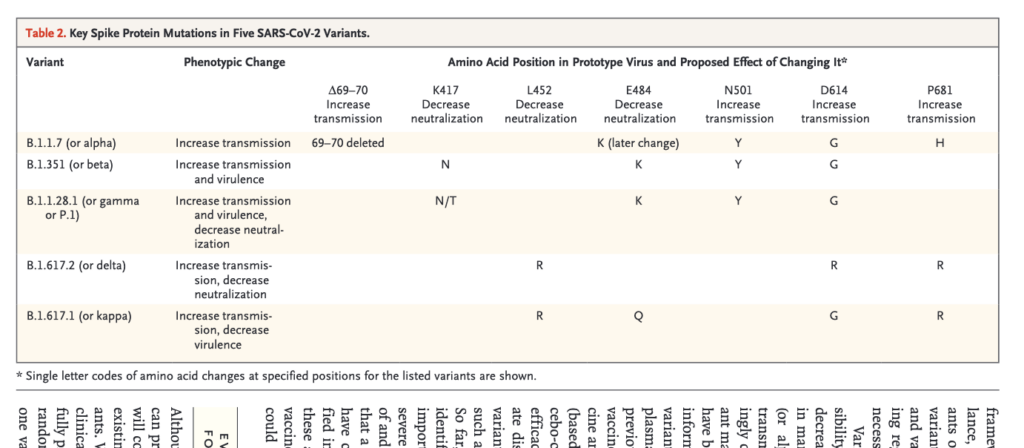
- De anger att det även behövs en internationell diskussion kring vilka antigenkomponenter som bör ingå i framtida versioner av vaccin (för att kunna motverka ev. nya varianter), och redovisar i tabell 2 (se skärmdumpen nedan) mutationer som tycks varit gemensamma för
flera varianter.
3. Preprintstudie tyder återigen på relativt gott skydd av vaccinen mot deltavarianten – inklusive från Modernas mRNA-vaccin
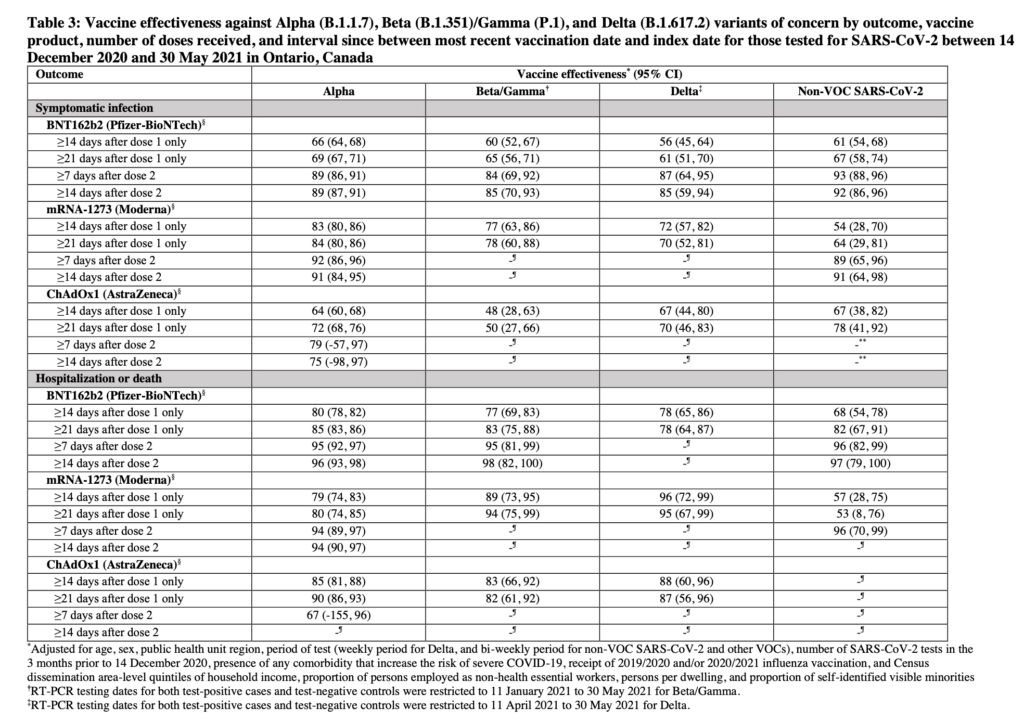
Slutligen finns en relativt ny preprintstudie där ett stort antal individer ingår, från Ontario i Kanada (Twitter-tråd här, utifrån denna studie av Nasreen et al.).
- I studien hade runt 1000 individer drabbats av delta-varianten, varav ~280 vaccinerade med Pfizer (av totalt 34 790 som fått vaccinet i studien), 56 vaccinerade med Moderna (av 7814) och 22 vaccinerade med AstraZenecas vaccin (av 5919).
- Modernas vaccin var (som väntat) också effektivt mot delta-varianten B.1.617.2: Både mot symptomatisk (70-72% skydd räknat 14-21 dagar efter dos 1), och mot svår/dödlig (95-96% skydd) COVID-19 orsakad av denna variant av SARS-CoV-2.
- De övriga vaccinen var också effektiva mot svår/dödlig COVID-19 orsakad av delta, ~78-96%, och som ses i tabellen nedan, runt 56-87% mot symptomatisk COVID-19. Dock sekvenserades inte alla fall av delta här, utan analysen bygger ffa. på indirekta mutationsanalyser (som överlag korrelerade väl med de 538 prover som hade sekvenserats).
- I preprintstudien har de även med fall av beta (B.1.351). Där har ju tidigare data från en mindre studie tytt på att AstraZeneca inte är effektiv mot beta-varianten (beskrivet i mitt tidigare inlägg, samt i denna NEJM-studie).
- I den nya studien tycks en första dos av AstraZenecas vaccin ge ett visst (runt 48-50%, 95% CI 28-66) skydd mot symptomatisk COVID-19 orsakad av beta (B.1.351) eller gamma (P.1)-varianterna, men skyddet mot svår sjukdom är desto bättre med 82-83% (95%CI 66-92). Därmed bör skyddet även vara bättre efter två doser (ses t.ex. för Pfizers vaccin i tabellen nedan, inklusive just för beta/gamma-varianterna).
- Återigen visar datan därmed att just två doser ger betydligt bättre skydd. Men Modernas vaccin (som har betydligt högre mRNA-mängd, 100 µg, än Pfizers vaccin, 30 µg, per dos) tycks alltså kanske skydda något bättre, enligt vissa mått. Detta stämmer med en del annan immunologisk data (se t.ex. detta tidigare inlägg, och denna preprintstudie).
- För få fall av varianten delta fanns för att bedöma skyddet mot delta efter två doser av Modernas och AstraZenecas vaccin, men det var 87% från Pfizers mot symptomatisk sjukdom (95% CI 64-95)
- Mer om skyddet mot delta finns i mitt tidigare inlägg.
Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD/senior forskare
Nedan tabell 3 som visar skyddet mot olika varianter, från Moderna, Pfizer och AstraZenecas vaccin, utifrån Ontarios data, i preprintstudien av Nasreen et al. (DOI: 10.1101/2021.06.28.21259420)