- Seropositiva (de med genomgången SARS-CoV-2-infektion) kan ev. betydligt snabbare få höga antikroppsnivåer redan efter deras första dos, och bibehåller betydligt högre antikroppsnivåer jämfört med seronegativa individer även efter den andra dosen. Detta enligt en mindre preprintstudie från en välrenommerad grupp. I studien har de studerat individer som har fått någon av mRNA-vaccinen (BNT162b2 från Pfizer; eller mRNA-1273 från Moderna).
Såsom vid en andra exponering för mRNA-vaccinen, var frekvensen av biverkningar såsom feber högre vid den första dosen, hos de seropositiva individerna. Datan gällande god effekt på antikroppsnivåer, och även neutralisering av SARS-CoV-2 – redan efter en dos vaccin hos de med tidigare COVID-19 – stöds även av denna nya studie i The Lancet, samt en ny studie i JAMA.
1) Bakomliggande antaganden om effekten av seropositivitet
De spekulerade i att genomgången infektion (som gav seropositivitet) sannolikt liknar effekten av den första dosen för seronegativa individer, och att individer med pre-existerande immunitet brukar ha högre reaktogenicitet vid deras första dos av ett vaccin. T.ex. finns detta beskrivet för mässlingsvaccinet, även om data för influensavaccin kanske kan tala för motsatsen. Andra vaccin har undersökts för deras säkerhet hos seropositiva individer, ofta tycks det som med ganska få antal individer (se ex. här och här).
2) Seropositiva individer har ingått i många COVID-19-vaccinstudier, utan tecken på annat vaccinsvar
Som jag skrivit om tidigare har vi i AstraZenecas, Modernas och Pfizers studier en mindre men ändå nämnvärd andel seropositiva individer vid baseline, dvs. före inledd vaccinering:
- Runt 1.3-2.3 % av deltagarna i AstraZenecas (totalt 369) och Modernas studier (~699) tycks ha varit seropositiva vid baseline, dvs. antikroppar som tecken på genomgången infektion.
- Antar man att siffran är däromkring för Pfizers studie blir det ~totalt >1800 deltagare som var seropositiva innan de fick dos 1 eller 2 i dessa studier.
- I J&J:s mindre fas 1-2-studie, var 1-2% seropositiva (mot spike-proteinet) vid baseline), så en sådan förekomst tycks kunna vara giltig för många nu pågående vaccinkohorter.
- Inga avvikelser har noterats eller åtminstone beskrivits för dessa seropositiva individer i dessa studier.
3) Seropositivitet ökar nivåer av antikroppar av de mRNA-baserade vaccinen
Den nya studien har letts av Florian Krammer (vid Dept. of Microbiology, Mount Sinai) som anses vara mycket vederhäftig inom detta område (se t.ex. denna studie för hans tidigare bidrag gällande COVID-19). Den nya studie har publicerats i New England Journal of Medicine, men fanns tidigare som preprint.
- 109 individer inkluderades, varav 68 seronegativa och 41 seropositiva (de senare uppvisade alltså tecken på genomgången infektion med SARS-CoV-2). Deltagarna fick sin första vaccindos år 2020.
- De tittade sen på antikroppsnivåerna i olika intervall efter första dosen. Medan titrarna steg gradvis hos de seronegativa (t.ex. 439 dag 9-12; 1,075 dag 21-24) (detta är AUC), så steg de mycket hastigt hos de seropositiva, trots låga nivåer hos de senare före själva vaccineringen.
- Hos de seropositiva nådde nivåerna 13,208 dag 5-8 och 16,263 dag 21-24.
- Därmed var skillnaden kraftigt signifikant skild mellan grupperna: vid många tidpunkter 10-20 gånger högre hos de seropositiva vid ekvivalenta tidpunkter (se övre delen av bilden nedan). Även efter den andra dosen så sågs nära sju gånger högre antikroppar hos de tidigare seropositiva individer (22,509 (n=19) kontra 3,316 (n=36)) – här anges dock inte exakt dag och antalet individer blir gradvis färre ju senare tidpunkt som undersöktes.
- När det gäller de systemiska reaktionerna (trötthet, huvudvärk, frossa, myalgi, feber och artralgi) sågs mer frekventa sådana efter den första dosen hos de seropositiva kontra seronegativa (nedre delen av bilden nedan).
- Här undersöktes 230 individer (148 seronegativa, 82 seropositiva). 46% av de seronegativa och 89% av de seropositiva fick någon biverkan. Lokala biverkningar tycks ha varit lika frekventa oavsett serostatus.
- Högre förekomst av systemiska reaktioner efter en andra exponering, beror sannolikt pga. kraftigare cytokinutsöndring då utifrån ett mot Spike-antigenet redan “prime:at” immunsystem, hos de seropositiva individerna. Både för Pfizer och Modernas vaccin är frekvensen av sådana biverkningar för övrigt högre efter den andra jämfört med första dosen (direktlänkar här, här och för NEJM-studie här). Många beskriver därmed att den första dosen är beskedlig, men att man t.ex. kan behöva stanna hemma från jobbet 1-2 dagar efter den andra dosen (tycks ej gälla för AstraZenecas eller J&Js vaccin; se bl.a. min sammanställning av vanliga vaccinbiverkningar här)
I studien anger de att de håller på att följa upp dessa antikroppssvar ytterligare. Antagligen kommer liknande studier göras för de andra vaccinen.
Därtill föreslår de att man ev. skulle kunna screena personer för antikroppsstatus mot Spike-proteinet, för att t.ex. minska på förbrukningen av antalet vaccindoser (dvs. att seropositiva före vaccinering då skulle kunna få enbart en dos). Dock nämner de inte att man då borde ta hänsyn till risken för falskt positiva, tidsförbrukning och organisatoriska aspekter. Därtill är denna analys enbart baserad på antikroppar, till skillnad från efficacy fas-3-studierna som undersökts det faktiska skyddet mot infektion (samtidigt som andra studier tyder på att risken för reinfektion överlag låg inom de första månaderna, ifall man har antikroppar mot spike-proteinet: länk här, däremot finns det andra stuider som talar för en ändå betydelsefull möjlig risk för reinfektion, se min tidigare post här).
Intressant nog föreslog Prof. Krammer själv möjligheten till en endos-strategi för seropositiva, bara för några veckor sen, och att man just borde titta på detta i studier (länk). Samtidigt har han också förespråkat att man inte ska avvakta med den andra dosen, då en sådan strategi kan påskynda utvecklingen av [möjligen resistenta] varianter av viruset (om man inte har tillräcklig immunitet för att minimera transmissionen ifall man blir smittad).
3.1) Ytterligare studie i JAMA indikerar att tidigare infektion ger höga antikroppsnivåer efter en första vaccindos
Ungefär samtidigt med ovanstående studie kom det en till studie med mycket likartade resultat, av Saadat et al. (tidigare preprint, men nu publicerad i JAMA).
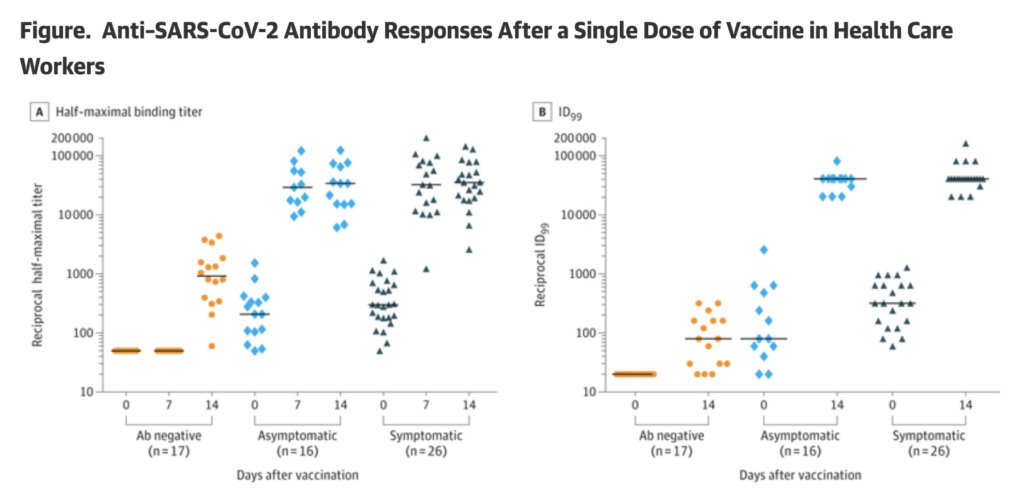
- Här har har de även delat in dem i symptomatiska och asymptomatiska (tyvärr saknades den informationen i förra studien ovan av Prof. Krammer). De finner att bägge dessa grupper, får betydligt högre antikroppsnivåer jämfört med seronegativa individer (dvs. individer som tidigare inte har haft COVID-19), med runt 512 gånger starkare (40920 kontra 80) neutralisation av viruset (in vitro) 14 dagar efter den första dosen av Pfizer- eller Moderna-vaccinet (vaccin av typen mRNA-vaccin). Se även den andra bilden nedan.
- Noterbart var att de här finner att man efter vaccinering har betydligt högre antikroppsnivåer (titrar) även jämfört med de som nyligen har haft COVID-19, där blod tagits 1-2 månader efter deras insjuknande – den tidpunkt då antikroppsnivåer är som högst. Sammantaget visar deras resultat hur vaccinering kan förbättra immuniteten även hos de med tidigare COVID-19.
- I den här studien nedan saknas dock närmare information om svårighetsgrad och de har bara testat effekten av en vaccindos. Därtill finns ingen data om reaktogenicitet (dvs. vilka biverkningar såsom feber man får), beroende på om man tidigare har haft COVID-19 eller inte. Ev. kan sådan information komma senare (men hade det varit anmärkningsvärt hade de nog rapporterat om detta i samma publikation)
Citat från deras diskussion: “Health care workers with previous COVID-19 infection, based on laboratory-confirmed serology testing, had higher antibody titer responses to a single dose of mRNA vaccine than those who were not previously infected. Antibody titers started peaking at 7 days and achieved higher titers and neutralization in 14 days compared with Ab-negative volunteers. Limitations of the study are the small sample size, lack of demonstration of vaccine efficacy, and potential bias introduced by those enrolling not being representative of the larger original population. Given the ongoing worldwide vaccine shortages, the results inform suggestions for a single-dose vaccination strategy for those with prior COVID-19 or placing them lower on the vaccination priority list.“
4) Korrelation saknas mellan vaccinsvar/reaktogenicitet och immunologiska svar på vaccin
- Det tycks inte finnas ett tydligt korrelat mellan reaktogenicitet (t.ex. utvecklandet av feber och frossa) och vilket svar man får på ett vaccin (åtminstone inte i form av antikroppar, tänker att korrelat i form av skydd mot faktiskt sjukdom säkert är ännu svårare att etablera). Dvs. konceptet “no pain, no gain” har inte konsekvent stöd (t.ex. finner vissa studier att vaccinsvar som dämpas med febernedsättande inte påverkar vaccinsvaren), se t.ex. studier här, här och här.
- Det finns säkert fler studier, men i stället finner denna på influensa-H1N1-vaccinet bland barn, att ett korrelat på antikroppstitrar (HI-inhibering) efter vaccinering var högre hos de som fick kontra inte utvecklade högre feber efter vaccinering: här i tidskriften vaccin.
- Review-artikeln ovan i nature-tidskriften npj Vaccines konstaterar för övrigt att tidigare genomgången sjukdom inte brukar utgöra hinder för vaccinering: “With few exceptions, natural immunity has not been found to affect the overall safety profile of vaccines targeting the said pathogen. Efforts to correlate pre-vaccination antibody titres with the incidence of injection-site or systemic reactions following vaccination have not identified consistent associations.”
- Studien om seropositivas vaccinsvar igen: I NEJM och som preprint-studie.
- Länk till liknande studie i The Lancet här.
- Liknande studie i JAMA här.
Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD/senior forskare
Bild nedan från preprintstudien av Krammer et al (längre ner från JAMA-studien):
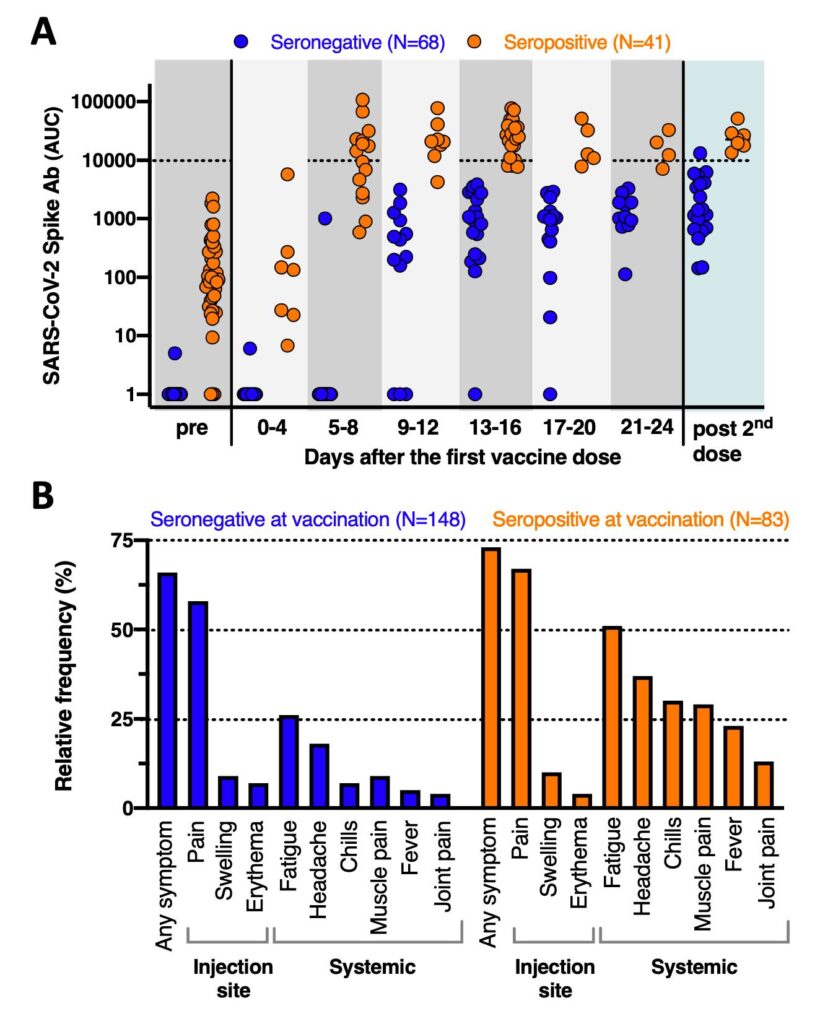
Bild från studien av Saadat et al., JAMA, 2021: