Nya studier i Nature och NEJM tyder på att vaccinen ger ökat skydd mot flera SARS-CoV-2-varianter, inklusive den som sprids i Kalifornien (B.1.427/.429), samt att infektion med den som upptäcktes i Sydafrika – B.1.351 – bör ge god korsimmunitet mot andra varianter av SARS-CoV-2
Det senare bör båda gott för vaccin som bygger på denna variant, såsom Modernas nya boosterkandidat mRNA-1273.351, som nu börjat användas i en påbyggnadsstudie.
Därtill tyder även tidigare in vitro-studier just på att skyddet mot B.1.351 (som identifierades i Sydafrika), är försämrat även från flera vaccin.
- För den som är mindre intresserad av bakomliggande biologin, kan man hoppa över den första delen nedan om mutationerna. Notera att nedanstående främst handlar om så kallade in vitro-studier, där man studerar hur antikroppar isolerade från individer fungerar mot varianter av viruset som orsakar COVID-19, SARS-CoV-2. In vitro-studierna inriktas mot antikroppars neutraliserande effekt, och kan värderar därmed inte det ev. betydelsefulla T-cellsbaserade skyddet, som de flesta vaccin tycks ge.
- För kliniska studier – där man studerar det faktiska skyddet för individer mot varianter av SARS-CoV-2 – se t.ex. detta och detta tidigare inlägg på min blogg. Denna nyare Twitter-tråd går även igenom preliminär data som tyder på att Pfizers vaccin troligen skyddar mot COVID-19 orsakad av varianten B.1.351.
1) Översikt av mutationer i proteinet Spike i varianterna B.1.1.7 (den “brittiska”) och B.1.351 (den “sydafrikanska”)
New York Times har en pedagogisk översikt över varianterna och deras mutationer, här. Mutationer i t.ex. N-terminala domänen (NTD) och receptorbindande domänen (RBD) är bland de mer bekymmersamma, pga. risken för påverkan på hur antikroppar fungerar. Dessa mutationer kan även påverkar hur virusets binder till celler (via dess receptor, ACE2).
Varianten B.1.1.7, som upptäcktes i Storbritannien (kallas därför oftast för den “brittiska”) har följande 8 mutationer i spike-proteinet, det protein som de i Sverige nu godkända vaccinen är inriktade på:
-
Deletion 69-70 och 144 (dessa är i NTD) (deletion 69-70 för att man får S target gene failure (SGTF) och därmed kan upptäcka med vanlig PCR om man har med S-genens primerpar)
-
N501Y (mutation I RBD)
-
P681H (nära den så kallade furine cleavage site; en viktig del för aktivering av viruset, för senare infektion av celler – se gärna denna artikel)
-
A570D, T716I, S982A, D1118H
-
Se t.ex. även denna sammanställning.
B.1.351 upptäcktes i Sydafrika (kallas därför oftast för den “sydafrikanska”) har i stället följande 9 mutationer i spike-proteinet:
-
Deletion 242-244 (denna är i NTD, N-terminala domänen)
-
R246I
-
K417N, E484K, N501Y (dessa 3 är i RBD)
-
A701V och P681H (bägge nära den så kallade furine cleavage site)
-
Deletion 144
-
N501Y (mutation I RBD)
Den Brasilien-identifierade varianten P.1. har flera av de mutationer som B.1.351 har: E484K, K417T, N501Y, se denna länk.
2) En dos vaccin hos de med tidigare COVID-19 ger påtaglig ökning av antikroppsnivåerna mot flera varianter av SARS-CoV-2.
Denna nya studie av Lustig et al. i New England Journal of Medicine bygger på ett fåtal tidigare COVID-19-smittade individer (6 sjukvårdsarbetare). De fick blod draget flera gånger för att kunna bedöma skyddet efter deras naturliga infektion, kontra senare både före och efter vaccination mot COVID-19:
-
Alla deltagare var kvinnor som hade smittats med originalvarianten (typ B.1), 5/6 hade mild sjukdom (en sjukhusvårdad) och en var asymptomatisk. De vaccinerades runt 300 dagar efter sin infektion.
-
En neutralisations-assay utfördes med blod taget 1-12 veckor efter naturliga infektionen; direkt före vaccinering, och 1-2 veckor efter första dosen av Pfizers mRNA-vaccin.
-
De utförde neutralisationsassay i VERO-E6-celler med originalisolat av typen Wuhan (B.1.1.50), B.1.1.7, P.1. och B.1.351 (spädning av serum över 1:10 räknades som neutralisering).
-
Provet nära infektion uppvisade neutralisationsvärden på 456, 256, 71 respektive nära noll, för varianterna Wuhan (B.1.1.50), B.1.1.7, P.1. och B.1.351.
-
Direkt före vaccinering (~300 dagar efter infektionen), var neutralisations-titrarna lägre (dvs. sämre skydd), på 81, 40, 36, respektive 7.
-
1-2 veckor efter vaccindosen steg titrarna markant, till 9195, 8192, 2896 och 1625 mot Wuhan-, B.1.1.7-, P.1- och B.1.351-varianterna. Dvs. en stegring på 81-228 gånger, med ett ganska homogent svar.
-
Författarna anser deras fynd belyser vikten av vaccinering av de med tidigare COVID-19, men de har inte kunnat bedöma T-cellssvaret, och kohorten var givetvis liten.
- Mer om hur en dos ger kraftigt ökade antikroppsnivåer mot SARS-CoV-2, i detta tidigare inlägg.

3) Modernas och Novavax vaccin ger bra in vitro-skydd mot varianten B.1.429, men sämre skydd mot B.1.351
I Kalifornien sprids varianten B.1.427/.429 (även kallad CAL.20C eller 542R.V1) snabbt. Den har några oroväckande mutationer i spike, t.ex. L452R och W152C, som kan påverka antikropps-inbindningen. I denna nya studie i NEJM mätte Shen et al. neutralisationsförmågan från serum från 14 tidigare COVID-patienter, samt 26 mottagare av Modernas vaccin mRNA-1273 och från 23 mottagare av Novovax subunit-vaccin (NVX-CoV2373).
-
B.1.429 uppvisade en 2-3-faldig sämre neutralisering, dvs. ungefär i nivå med vad B.1.1.7 kan orsaka, jämfört med föregående variant av SARS-CoV-2. Om denna cirka tvåfaldiga reduktion av B.1.1.7 har samma författare rapporterat tidigare, för samma två vaccin.
-
B.1.351 (den Sydafrika-identifierade varianten) gav som tidigare rapporterat en större minskning: Runt 13 gånger för konvalescensserum, 9.7 för serum från de som fått Modernas vaccin, och 14.5 gånger lägre från de som fått Novavax vaccin.
4) Infektion med varianten B.1.351 tycks ge ett korsreaktivt skydd mot andra varianter av SARS-CoV-2
I ytterligare en studie i NEJM, av Moyo-Gwete et al. har forskare fokuserat på huruvida infektion med varianten B.1.351 kan skydda mot andra varianter av SARS-CoV-2.
-
Artikeln har tidigare funnits som preprint.
-
Bland individer som med sekvensering hade tidigare bekräftad B.1.351-infektion, fann de att antikroppar mot Spike band bra mot samma variant av Spike, men bara något bättre (1.7 gånger) än mot original-varianten.
-
Från nästan samtliga (19 av 22) av de som infekterats med B.1.351, neutraliserade antikropparna även originalvarianten av SARS-CoV-2, och av 10 sådana (B.1.351-) testade prover, neutraliserade samtliga den Brasilien-identifierade varianten P.1.
-
Se gärna även detta inlägg, som beskriver upp AstraZenecas vaccin som har ungefär samma grad av (in vitro-baserad) reduktion i effekten mot B.1.351, som Pfizers vaccin (se punkt 6).
I en liknande ny studie av Cele et al. i Nature, visar författarna att B.1.351 har försämrad neutralisering från antikroppar som man erhållit från infektion med föregående varianter av SARS-CoV-2. De ser samtidigt att infektion med varianten B.1.351 däremot ger korsreaktivt bra skydd mot tidigare varianter:
-
För de som smittats av andra varianter (icke-B.1.351), i första vågen, sågs en reduktion på ~15 gånger i neutralisering mot varianten B.1.351, som alltså brukar betecknas som den sydafrikanska varianten (men som egentligen borde sägas ha identifierats där).
-
För de som smittats av B.1.351 sågs däremot bara 2.3 gångers reduktion mot de varianter som cirkulerade under Sydafrikas första våg (dvs. icke-B.1.351).
-
En begränsning som nämns med denna lite mer utförligt beskrivna studie, är att individerna som smittats av B.1.351 i andra vågen, ev. även kan ha smittats av tidigare varianter i första vågen. De hade dock gjort telefonintervjuer för att undersöka detta, men det lämnar givetvis ev. exempelvis asymptomatiska infektioner oupptäckta.
-
Intressant nog fanns det en deltagare som utav alla möjliga mutationer som finns i B.1.351, bara hade mutationen E484K (en mutation som minskar effekten av antikroppar, se även mitt tidigare inlägg). Denna individs antikroppar var de mest potenta att neutralisera både första vågens virus och B.1.351, men de vet ej varför.
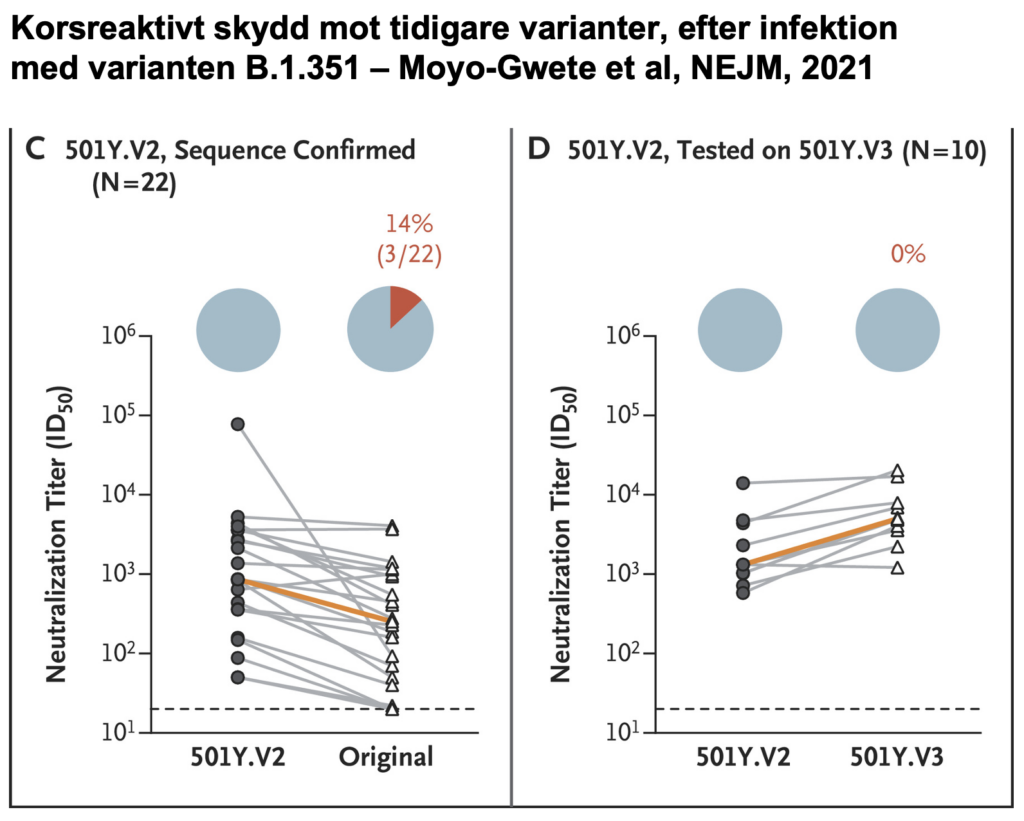
Analyser i NEJM och Nature finner att varianten B.1.351 sänker neutralisationsförmågan in vitro av både Pfizers och Modernas vaccin. Analysen i NEJM tyder på att Pfizers vaccin fungerar in vitro (dvs. ej kliniskt testat) även mot varianten P.1.
Även hos de med COVID-19 ses sänkt neutralisering, men några individer tycks bilda antikroppar med närmast helt opåverkad neutralisation mot varianter som B.1.351. Än saknas klinisk data för hur Modernas vaccin kan skydda mot B.1.351 eller P.1. För den senare (P.1) tycks klinisk information ännu inte finnas för de övriga vaccinen heller – men det in vitro-baserade skyddet tycks sammantaget lovande. Informationen finns även här på Twitter i kortformat.
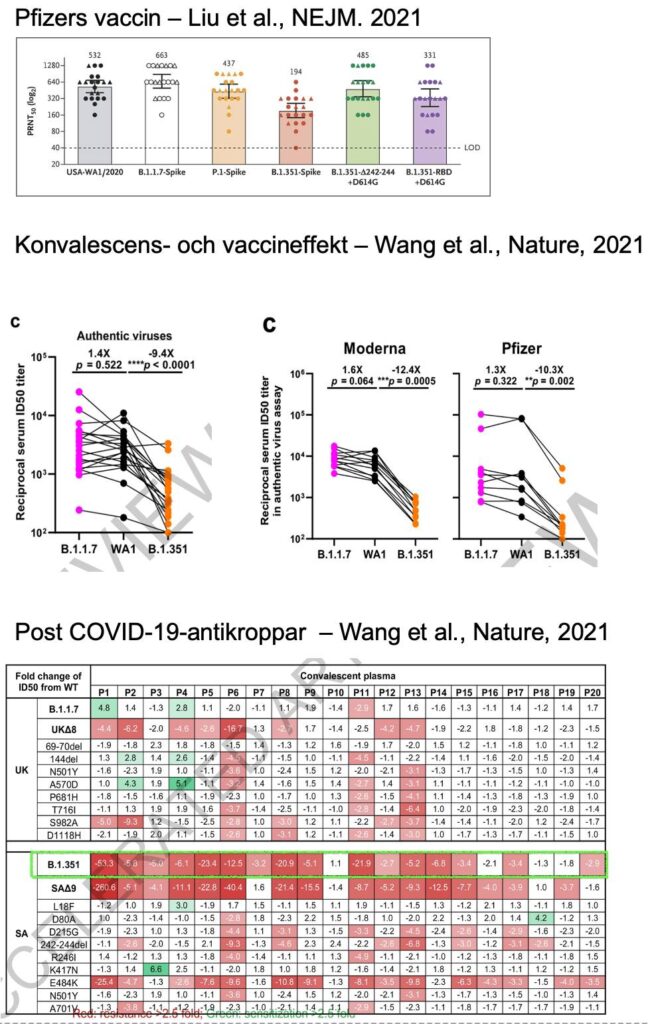
5) Påverkan av varianterna B.1.1.7, B.1.351 och P.1, av antikroppar efter vaccinering med Pfizers mRNA-vaccin (i NEJM)
I artikeln i NEJM modifierade Liu et al. USA:s ursprungsisolat av viruset SARS-CoV-2, så att den hade mutationerna i varianterna B.1.1.7, B.1.351 och P.1. De gjorde även varianter som bara hade en del av mutationerna i B.1.351 (se även bilden nedan)
-
De använde ”gold standard” 50% plaque reduction neutralization testing (PRNT50) med prover från 15 deltagare (2-4 veckor efter 2:a dosen)
-
De fann att B.1.1.7 neutraliserades i snitt som ursprungsvarianten, med liknande (tycktes vara lite sämre) resultat för P.1. Neutraliseringen av B.1.351 var i stället betydligt mer sänkt (halverat värde på en log2-skala).
-
De modifierade virusen som bara hade en del av mutationerna från B.1.351 inte fullt lika försämrad neutralisering. Oavsett variant kunde viruset neutraliseras till viss nivå
-
Deras data tyder indirekt på att mutationerna K417N, E484K och N501Y är mer problematiska i t.ex. B.1.351.
-
De tolkar den neutraliserande aktiviteten (hur mycket de kunde späda antikropparna för detta) som att de utifrån deras tidigare data och endos-efficacydata, är tillräckligt med aktivitet för Pfizers vaccin även mot B.1.351.
6) Påverkan av B.1.1.7 och B.1.351 av antikroppar från konvalescenssera, samt Pfizers & Modernas vaccinantikroppar
I artikeln i Nature av Wang et al. har de kanske kommit allra närmast att se hur antikroppars funktion påverkas av de “riktiga” varianterna B.1.1.7 och B.1.351. Detta eftersom de använde autentiskt virus (kräver BSL3-lab, medan pseudovirus kan hanteras på lägre säkerhetsnivå, se gärna denna sammanfattning), men de skapade också samtidigt just pseudovirus som hade de enskilda mutationerna.
-
De tittade först på hur monoklonala antikroppar påverkades, och fann att de terapeutiska monoklonalerna bamlanivimab och casirivimab – riktade mot RBD – knappt fungerade mot B.1.351 (de tittade på än fler monoklonala antikroppar som beskrivs närmare i artikeln)
-
Vissa monoklonala antikroppar påverkades negativt mot B.1.1.7, det tycktes vara genom mutationen N501Y. De analyserade även kombinationer av monoklonaler (såsom regenerson) och såg att de kvarhöll aktivitet, men att den var sänkt.
-
De monoklonala antikroppar som påverkades negativt mot B.1.351, tycktes göra det pga. mutationerna E484K och K417N
-
När de analyserade konvalescensera från 20 patienter (taget ~1 månad efter infektion med SARS-CoV-2 under våren 2020), fann de ungefär bibehållen neutralisation mot B.1.1.7, men däremot över 9 gångers försämring mot B.1.351. De fann dock några individer som hade närmast oförminskad neutralisering oavsett sammansättning av spike-mutationer, och antyder att dessa bör studeras närmare (se bilden nedan, de vita rutorna i den inringade gröna delen, liksom detta BBC-inslag)
-
I separata försök med enskilda mutationer, kunde de även här bekräfta att E484K tycks vara den mutation som försämrar neutraliseringen mest.
-
De tittade slutligen på serum från vaccinerade individer: 12 som vaccinerats med Modernas vaccin (bägge doser, med blod draget två veckor efter 2:a dosen). 10 som vaccinerats med Pfizers vaccin (bägge doser, med blod draget ≥8 dagar efter 2:a dosen)
-
De såg ingen reduktion i neutralisering mot B.1.1.7 men en 10.3-12.4 gångers reduktion mot B.1.351, med antikroppar erhållna efter vaccinering med Modernas och Pfizers vaccin. I separata analyser såg de även här att E484K i varianten B.1.351 tycktes vara den som minskade neutraliseringen.
I diskussionen lyfter författarna i Nature-artikeln att P.1 också har bl.a. E484K och tror att reduktionen skulle vara likartad mot denna variant. De lyfter även att tidigare rapporter som funnit mer bibehållen effekt mot B.1.351, använt pseudovirus. Dvs. ett substitut som inte behöver vara identiskt med det riktiga viruset, som författarna har testat i Nature-artikeln
- Notera att Novavax och J&J har visat ett måttligt men (jämfört med “vildtyp”) något sänkt skydd mot B.1.351 i sina studier (genomgång här och här). Dessa finns dock ej ännu att granska i publicerad form, men FDA gjorde informationen för J&J nyligen mer offentlig (64% effekt i sydafrika), i den dokumentation som därefter möjliggjorde att J&J kunde börja användas i USA (länk här).
- Se gärna detta tidigare inlägg kring hur AstraZenecas och Pfizers vaccin fungerar in vitro mot B.1.351. Därtill finns som ovan nämnt nu preliminär data som tyder på Pfizers vaccin fungerar kliniskt mot B.1.351.
- Däremot tycks en mindre studie tyda på att AstraZenecas vaccin inte skyddar mot mild till måttlig COVID-19 orsakad av B.1.351 (se punkt 4 här). Däremot kan skyddet mot svår sjukdom vara bevarat (ännu ej studerat).
- Delvis obekräftade källor har dock gjort gällande att AstraZenecas vaccin och kinesiska Sinovac (engelsk länk här) ska fungera mot den i Brasilien upptäckta och välspridda varianten P.1. Denna variant har även kopplats till en ökad dödlighet bland yngre, enligt en studie som ännu bara finns i preprintversion (Twitter-tråd om studien här).
7) Moderna har påbörjat sin kliniska studie med ett uppdaterat mRNA-vaccin baserat på varianten B.1.351
I Modernas nya studie kommer tre armar att ingå, med 20 deltagare i varje studiearm. Samtliga deltagare har redan ingått i deras tidigare fas 2-studie (och är därmed vaccinerade med deras första vaccinkandidat). De tre studiearmarna:
-
20 µg av deras nya boosterkandidat (mRNA-1273.351), som är inriktad på spike-proteinet från varianten B.1.351.
-
50 µg av deras booster (mRNA-1273.351)
-
50 µg av en multivalent booster (.211), som innehåller både mRNA-1273.351 och originalversionen mRNA-1273.
-
Som tidigare beskrivet ger en halverad vaccindos ett bra immunologiskt svar från Modernas vaccin. Nuvarande version av Modernas vaccin ges med 100 µg men de testar här alltså 20-50 µg.
8) I andra korta nyheter:
-
Uppsala har tyvärr ett extremt ansträngt coronaläge, med 25% av platserna upptagna av covidpatienter, här beskrivet av Fredrik Sund.
-
Likaså har både Brasilien (4000 dödsfall rapporterade igår) och Indien (kraftigt ökande smittspridning) svåra lägen. Brasilien domineras som tidigare nämnt av P.1 (även P.2), men de har ett flertal till varianter. Indien domineras nu också av B.1.1.7 (>80% enligt en analys).
-
EMA medger att det finns en möjlig länk till blodproppar med AstraZenecas vaccin, men att det är ovanligt och att nyttan överväger riskerna för de flesta. Det ska därmed listas som en mycket ovanlig biverkan för vaccinet. Rapporten bygger på 86 fall av 25 miljoner vaccinerade Européer. Specifika riskfaktorer för dessa ovanliga händelser kunde inte identifieras säger de, men de flesta har inträffat hos de under 60 år. Mer om den kopplingen här, där ev. koppling till VAPIT / HIT beskrivs. AstraZenecas vaccinstudie har stoppats bland barn (av försiktighetsprincipen) i Storbritannien, och EMAs kommitté PRAC har bedömt en rad möjliga potentiella mekanismer. De fann t.ex. det inte troligt att injektion av vaccinet av misstag i
ett kärl skulle öka risken för denna typ av ovanliga, mer allvarliga biverkan.
Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD/senior forskare