- The effect of the monoclonal antibody Bamlanivimab is adversely impacted, but that is already the case with several other variants (for such details, see my earlier overview here, and this Nature study). That’s why antibody cocktails, i.e. combinations, of monoclonal antibodies now have to be used (which anyways makes sense in order to reduce the risk of evolution of resistance against a single antibody
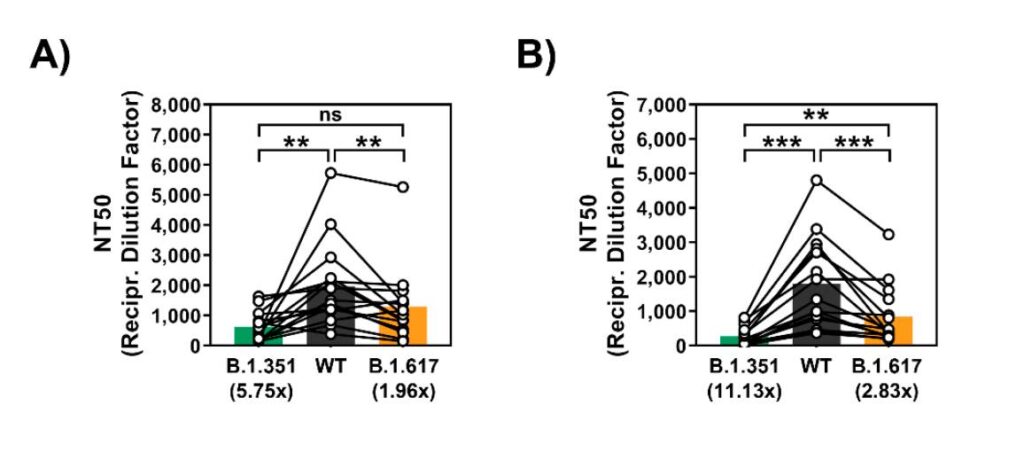
- As can be seen in the preprint, once more, it is B.1.351 (the South Africa-identified variant) that is the worrying variant for vaccine-generated antibodies. But new data is shedding light on how worried we may (not) have to be about B.1.351 (see section below figure).
- The figure below from the preprint by Hoffmann et al. shows that there is a circa 6 to 11-fold drop in neutralization activity against B.1.351, while the drop is only 2-3x against the Indian variant B.1.617 (which is an in vitro-based drop similar to that seen against variant B.1.1.7, against which we now know that Pfizer’s vaccine is highly effective; as also demonstrated by the new NEJM study described below)
However, vis-à-vis B.1.351 and vaccine-mediated protection, new data from Qatar in New England Journal of Medicine shows real-world data for how effective Pfizer’s mRNA vaccine is against that variant. So this means that we may not have to be worried if we are vaccinated with two full doses, and especially not against B.1.617, as this is far less troublesome for the vaccines (based on the above and below in vitro data).
The new Qatar data by Abu-Raddad et al. (2021) shows:
- Around 72-75% against all forms of SARS-CoV-2 infections (any documented infection) caused by B.1.351, when analyzing the period ≥14 days after the 2nd dose of Pfizer’s vaccine (protection even higher against B.1.1.7: 87-90%).
- 97.4-100% protection against severe, critical or fatal disease caused by SARS-CoV-2 variant B.1.351 (97.4% when all variants were considered; so technically even higher against B.1.351 specifically), when analyzing the period ≥14 days after the 2nd dose of Pfizer’s mRNA vaccine.
However, once more, the Qatar vaccine analysis shows how incomplete protection is after only the 1st dose of the vaccines:
- The corresponding numbers were ~17 and (!) 0-39% protection against all and severe/critical/fatal forms of B.1.351, respectively, after a single dose of Pfizer’s vaccine.
As a side note, even India’s inactivated COVID-19 vaccine (which many would probably argue is a vaccine inferior to the mRNA vaccines, at least given that it is not proven to the same extent in published studies), seems to be able to neutralize B.1.617 quite effectively. See this preprint by Yadav et al.
Thus, at least the parental B.1.617 variant does not seem to be that worrying. The subvariant B.1.617.2 may be worrying, but it does not seem to cause severe disease when you are vaccinated, preliminary data for that comes from England with AstraZeneca’s vaccine (thread here).
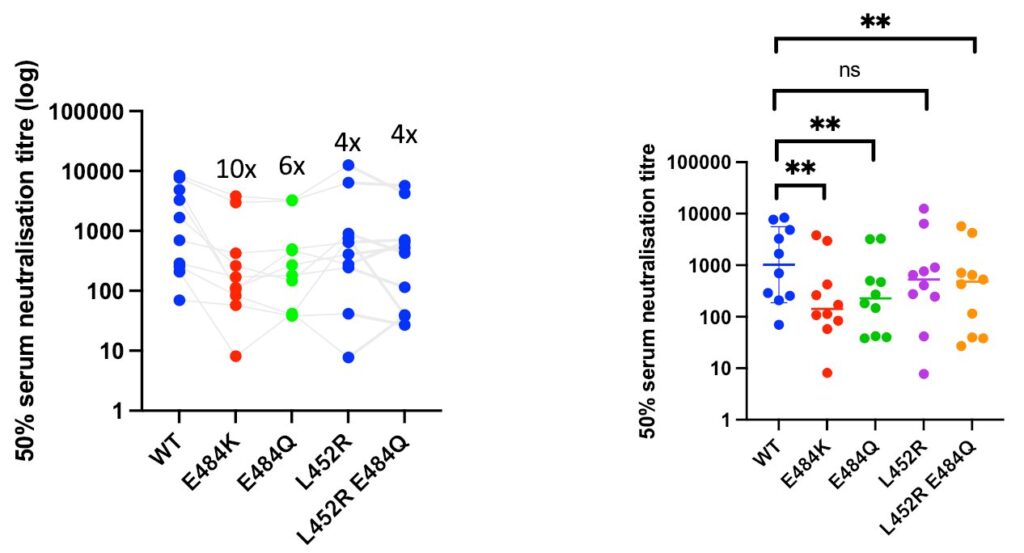
Finally, unpublished in vitro studies also show that the variant B.1.617 actually has a combination of mutations (L452R+E484Q) that may make it less prone to evade vaccine antibodies (again, this is not even published, but comes from a well-known lab), see the screenshot below from that Twitter thread.
As can be seen below, the mutation E484K (which for instance occurs in variant B.1.351, but not in B.1.617, produces a far greater drop in neutralization activity, as has been demonstrated in numerous studies). Yet again, as indicated above, real-world data shows that Pfizer’s mRNA vaccine at least is effective against this variant. Pfizer’s own data also indicates such preserved protection against COVID-19 caused by SARS-CoV-2 variant B.1.351 (unpublished data announced as a press release).