Reassuring mRNA vaccine safety data contrasts with severe Omicron impact in a poorly vaccinated area
After an initial summary in Swedish, each part is covered in English.
Säkerhetsdata för COVID-19 vaccinen är återigen betryggande, baserat på data från runt 300 miljoner givna mRNA-vaccindoser i USA (punkt 1). Därtill visar preliminär data på att SARS-CoV-2 men inte vaccinen ökar risken för död – inklusive kardiell – under de initiala veckorna, för den yngre gruppen i åldern 12-29 år.
- Samtidigt har Hong Kong under Omicron haft en case fatality rate på ~5%, dvs. högre än England hade under sin allvarligaste våg. Det visar därmed att Omicron inte alls behöver vara mild, särskilt inte när den äldre befolkningen varit mycket dåligt vaccinerad som i Hong Kong, där man även ffa. har använt Sinovac (kontra de mer effektiva mRNA-vaccinen) (Punkt 2).
- Men preliminär data från just Hong Kong visar – liksom för mRNA-vaccinen – att även Sinovac efter en 3:e dos ger mycket gott skydd mot svår COVID-19 orsakad av Omicron (också under punkt 2)
- När man i en preprintstudie sen analyserade dödligheten (kardiell och av alla orsaker) i åldrarna 12-29 år, så fann forskare att SARS-CoV-2 kraftigt ökade risken för sådan dödlighet under vecka 0-6 efter en infektion. Däremot sågs ingen ökad dödlighet efter vaccination (punkt 3).
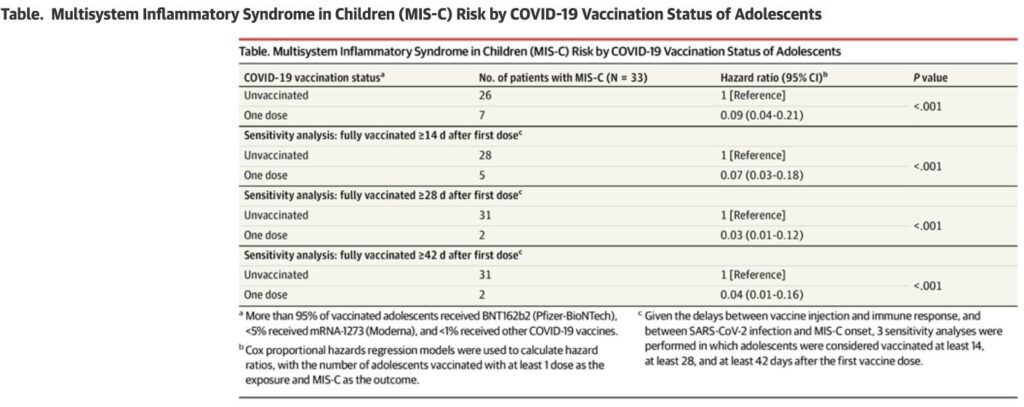
- Säkerhetsdata från tonåringar i åldern 12-17 tycks också visa — liksom tidigare data har tytt på — att den 3:e vaccindosen är kopplad till en mycket lägre risk för myokardit än den 2:a vaccindosen (i den nya analysen sågs ~11 kontra 71 fall per miljon givna doser) (punkt 3). Därtill tyder än mer data på att vaccinen ger ett hyfsat skydd mot svår COVID-19 även bland de i åldern 5-11. Se t.ex. studierna av Klein et al., Fowlkes et al., samt av Dorabawila et al. Eventuellt är vaccinskyddet bättre för de i åldern 12-17, som dock får en 3 gånger högre vaccindos än de i åldern 5-11 år.
1. COVID-19 vaccine safety data once more reassuring — based on 298 million administered mRNA vaccine doses
Safety data covering 298 792 852 administered doses of mRNA vaccines was recently published in the Lancet Infectious diseases, by Rosenblum and colleagues (twitter thread summary here). This covered ~340 000 analyzed VAERS reports: There were ~313 000 non-serious, and only ~22 500 serious reports – that is, there were ~0.007% serious events/reports out of the total ~300 million given mRNA vaccine doses. Compare this low rate with COVID-19, which prior to vaccine rollout had an infection fatality rate (IFR) of >0.5-1%. Even if the reported events are under-estimates (which can also apply to COVID-19 deaths), this demonstrates magnitudes of differences in risks from vaccines vs. COVID-19:
- An additional 7 914 583 v-safe self reports found the expected vaccine reactogenicity: <1% of participants reported seeking medical care after vaccination (0.8% after dose 1, 0.9% after dose 2). Furthermore, <0.1% of Pfizer / Moderna recipients were hospitalized.
- Of the few observed deaths that did occur (linked in time, does not mean causality) — as in any monitored population where some die of various causes over time — most were here older: The mean age was 76, IQR 66-86. No unusual pattern was seen.
- Important notes: A.) Also other vaccines show a small increase in deaths close to vaccination – this is expected, and possibly due to reporting bias because of intense monitoring. B.) EUAs require more intense reporting, such as of deaths, regardless of whether they can plausibly be linked to vaccination.
- The authors write: “Safety monitoring of COVID-19 vaccines has been the most comprehensive in US history and has used established systems, including the Vaccine Safety Datalink (VSD), VAERS, and a new system, v-safe, developed specifically for monitoring COVID-19 vaccine safety“
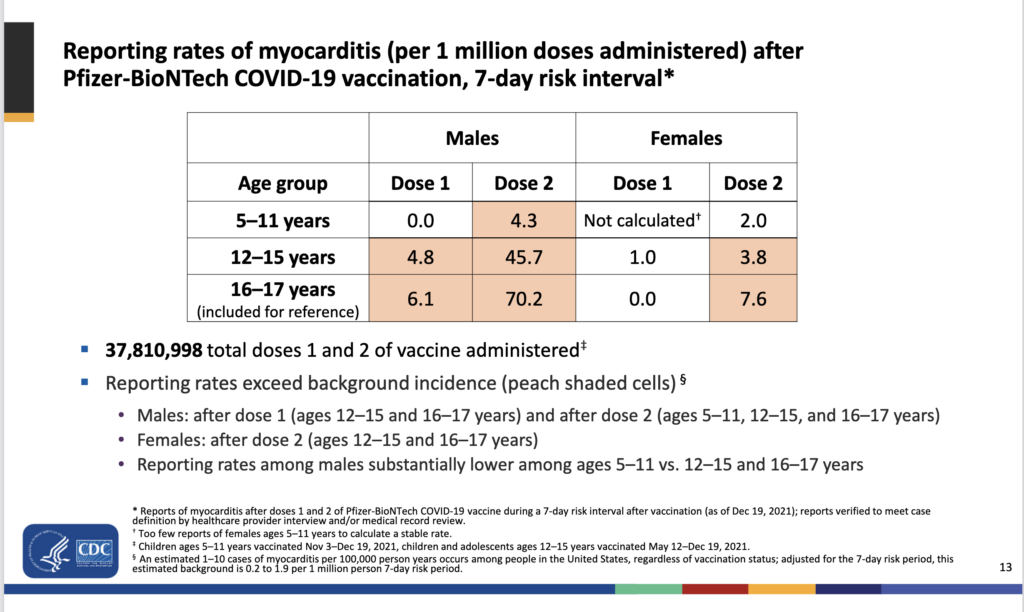
- Based on a similarly high number of administered doses (192 million), the myocarditis rate was recently also confirmed to be within the range reported earlier, ie up to ~1 case / 10 000 doses, in a study by Oster and colleagues: Out of the 826 monitored vaccine-associated myocarditis cases, none required the most intense treatment, such as ECMO or heart transplantation.
- This low rate can be compared with traditional myocarditis, which is often virally induced, where ~6-16% of children seem to require heart transplants.
- New CDC VAERS-based data reports that the vaccine-associated myocarditis risk was much lower for the 3rd vaccine dose (~11 cases per 3rd vaccine dose), compared with that seen after the 2nd vaccine dose (~71 per million 2nd doses), in the high-risk 12-17-year-old group.
- Earlier data has found that SARS-CoV-2 in most cases carries a higher risk of myocarditis (which is described as more severe vs. that associated with vaccines). The virus also increases the risk of various other cardiac & other serious conditions. And in their prior study, Al-Aly and colleagues found many risks were higher due to COVID-19 vs after the flu (granted not all flu seasons/viruses are the same). This was also seen in the studied by Taquet and colleagues (which I also describe in my earlier blog post).
- SARS-CoV-2 also seems to increase the risk of cognitive decline & a reduction in brain matter (foremost in olfactory brain regions) at least in middle aged individuals, according to a new study in Nature. Based on an increasing amount of data, vaccines most likely reduce these risks in breakthrough infections.
For information on the infection fatality rate (IFR) prior to vaccine rollout, please read e.g. this thread here. Especially the Delta variant increased severity/IFR, and Omicron lowered it, possibly to around the wild type level). Long term effects of Omicron are however still mostly unknown, such as the impact on cardiac or CNS health). These long term effects may also differ with new emerging variants.
Next, we turn to how Omicron hit Hong Kong, starting with this revealing analysis from the Financial Times:
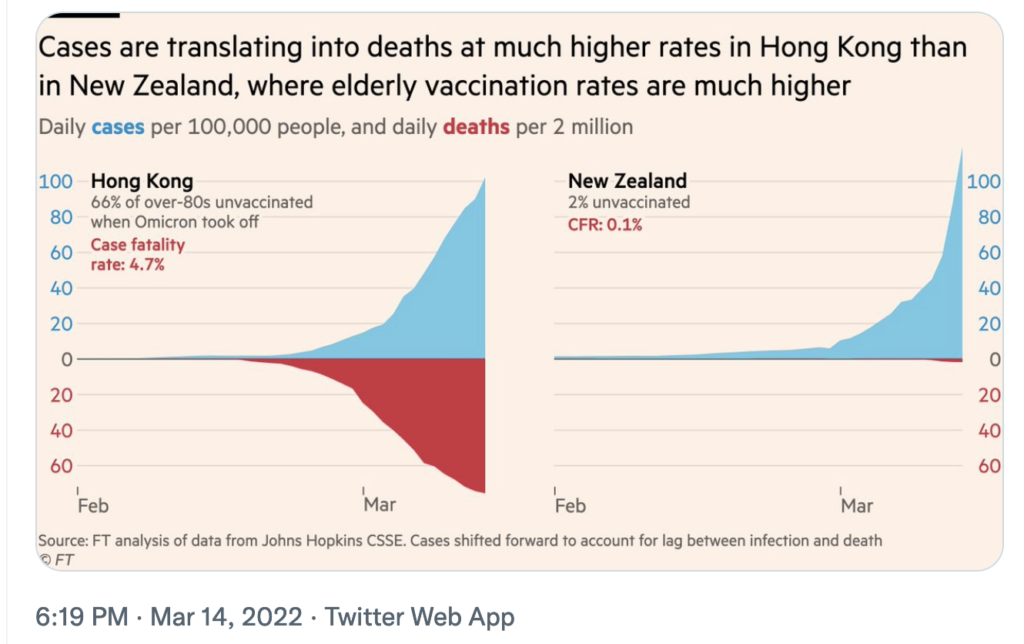
2. COVID-19 case fatality rate during Omicron in Hong Kong surpasses the pre vaccine era in England
This is not a peer-reviewed analysis in a scientific journal, but data analysts at the Financial Times have estimated that the mortality of COVID-19 may now be ~40 times lower than before vaccine rollout. Most of that change is thanks to the initial vaccine rollout (~11 fold reduction), but boosters and the Omicron variant has also reduced the infection fatality rate (IFR).
However, at the same time, Hong Kong just recently soared to the highest COVID-19 death rates worldwide: The case fatality rate was >5% and the death rate was at 25 per 100 000 individuals. So this demonstrated that Omicron is not just a “mild” disease when it hits a vulnerable, unvaccinated population.
- When Omicron hit Hong Kong, a whopping ~66% of the vulnerable 80+ population were unvaccinated. Compared with ~2% in New Zealand. Hong Kong saw a 4.7% case fatality rate, whereas it was only ~0.1% in the well-vaccinated New Zealand. So Hong Kong actually has recently had a higher case fatality rate than England did at its 2020 peak, even though we are now 2 years into the pandemic. Over 90% of those who recently died due to COVID-19 in Hong Kong were not fully vaccinated.
- Hong Kong has primarily used the inactivated (“traditional”) COVID-19 vaccine Sinovac. After 2 doses, protection against severe Omicron has been observed to be lower (~74%), compared with 2 doses of the the Pfizer vaccine (~89%), according to a recent preprint study. However, these estimates are higher than what has been reported based on some earlier data, e.g. from UKHSA (~50-70% vs. severe Omicron after 2 doses), but the data are consistent with preliminary Qatari data on mRNA vaccine effectiveness against Omicron.
- In any case, protection against severe COVID-19 in those vaccinated with Sinovac increased considerably after the 3rd vaccine doses (to ~98%). This level was similar to that offered by the 3rd dose of the Pfizer mRNA vaccine, in that same study.
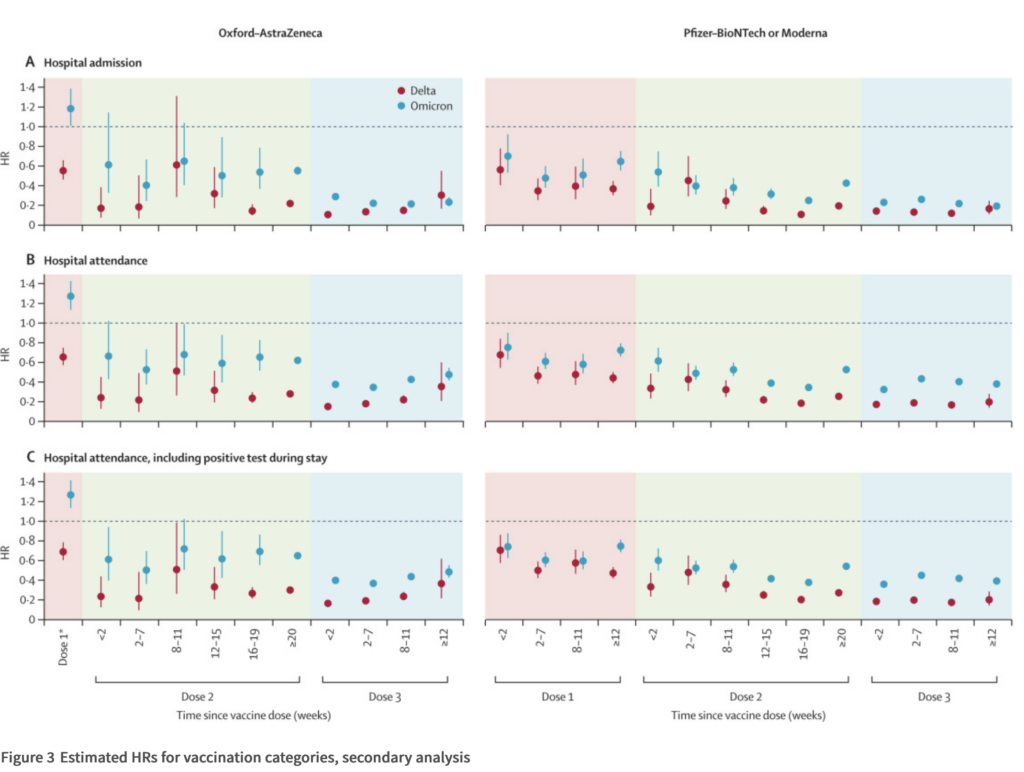
- At the same time, another analysis – published in the Lancet – has once more found that Omicrion is – relatively seen – less severe than the Delta variant. This was based on 1.5 million cases. The hazard ratio for hospital admission was 0.3 for Omicron compared with Delta cases — a 70% risk reduction.
- The analysis also found that prior infection offered about as much protection as a) two doses of the AstraZeneca vaccine, or b) as one Pfizer or Moderna vaccine doses (HR ~0.55), against hospitalization due to the Omicron variant. After a booster (i.e., any combination of 3 vaccine doses), vaccines consistently reduced the risk of hospital admission by 70% or more, compared with unvaccinated cases.
- The article also points out the important observation that Alpha and the subsequent Delta variant both seemed to increased the risk of hospitalization. So Omicron has brought the average severity down, when compared with the preceding Delta variant — but this is again a relative comparison: According to several assessments, the Omicron variant is therefore as severe as the original variant of SARS-CoV-2.
- For example, one analysis in Nature by Davies et al. found that Alpha was around 50% more deadly than the early 2020 SARS-CoV-2 (similar data here, and similar Swedish data here). Delta was in another analysis around 30% more virulent than Alpha.
The screenshot below, from the Lancet article by Nyberg et al., shows the risk reduction for hospitalization for vaccinated vs. unvaccinated cases, in cases with Delta or Omicron. The hazard ratio is essentially 1-vaccine effectiveness:
3. SARS-CoV-2, but not the mRNA COVID-19 vaccines, increased the risk of cardiac and all-cause deaths in 12-29-year-olds
A new preprint analysis from England, by Nafilyan et al., compared the risk of cardiac death and all-cause death from COVID-19 and the COVID-19 vaccine, among those aged 12-29 years.
They found that the vaccines either decreased (week 0-1) or did not change (week 2-6) the risk of cardiac or all-cause death (the early decrease is most likely due to the so-called healthy vaccinee effect). The six-week period is a useful period given how soon after administration vaccine side effects typically appear (usually within six weeks).
- In contrast, COVID-19 in unvaccinated individuals increased the risk of cardiac and all-cause deaths, by factor 4.4-6 in the first 6 weeks after an infection (compared with the baseline period). In the first week after an infection, the risk for cardiac-related deaths was 15 fold higher in those infected but not vaccinated.
- This was based on 212 all-cause deaths after SARS-CoV-2 and 585 deaths after COVID-19 vaccination, and looked at those who died within 12 weeks. The data for deaths after infection included those who died starting from Sep 2020, as that is when mass testing started (and again, Omicron carries a similar severity to the first variant, WA-1/2020, of SARS-CoV-2). Vaccinated cases were examined for the period December 2020 to February 2022.
- The method used here for the analysis is called a self controlled case series, where comparisons are made within individuals. This eliminates time-invariant confounding (such as gender and education level), and was specifically developed to assess vaccine safety. This is a design suitable for situations where for example most of the population has already received a treatment (such as a vaccine), and appropriate control groups are lacking, or may differ from the treatment (i.e., here vaccinated) group.
- Relevant to the above preprint analysis, a new CDC safety analysis based on monitoring of those age 12-17, found that the risk of myocarditis seems lower with the 3rd mRNA COVID-19 vaccine dose (recommended in the U.S. to those age 12-17): The rate was ~11 cases per million doses, compared with ~71 cases per million doses for the 2nd Pfizer mRNA COVID-19 vaccine dose.

Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD, docent i medicinsk cellbiologi