Note that many aspects regarding this variant are *very* preliminary, as is hopefully highlighted throughout the text.
1. The spread of omicron at this point
Omicron has already been detected in several places including in numerous spots in across Europe. Its further spread across Europe is therefore likely very hard to fully prevent, if it is a more transmissible variant than the Delta variant. Slowing its spread is a different aspect (more on that below).
Many argue that outright travel bans are just hurtful – like indicated above, a variant like this has already spread by the time it is detected (it likely originated/emerged around the start of October – so around 8 weeks ago).
If a country bans travel or trade with countries that reports a new variant, then it will de-incentivize countries from reporting new variants. Intense testing – and possibly [travel] quarantines – comprise a much more sensible approach, many argue. Here’s where more widespread use of face masks (high-grade filtration N95/FFP2-3 masks) and repeated or weekly rapid tests can help. Such rapid tests are excellent at detecting when someone is contagious.
South Africa did not have the first case of this variant, that was Botswana. But South Africa has done a tremendous job in analyzing data related to the emergence of this variant, and may soon deliver the first data – in vitro-based – on how the vaccine fares against it (in their recent briefing on Omicron, local scientists said they would also examine T cell responses).
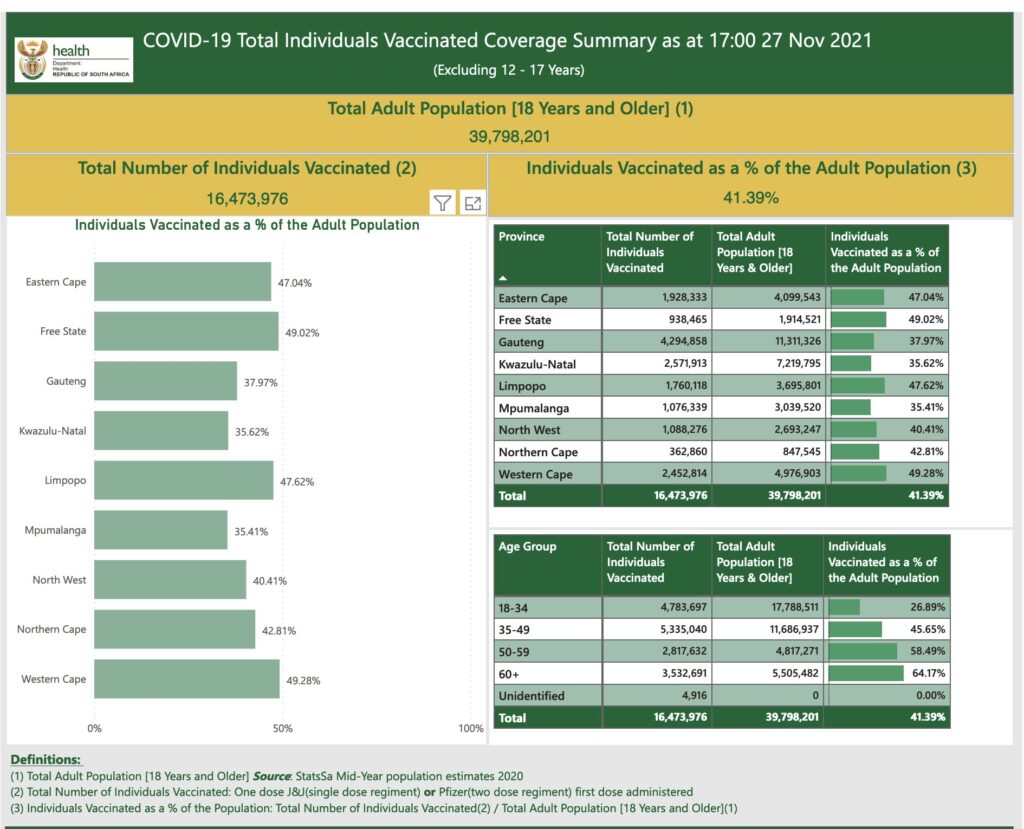
Yet, South Africa has only fully vaccinated <24% of its population. Meaning this increases the risk that many people fall ill – especially if they get transmission of a highly transmissible variant. Data also indicates that low vaccination rate increases the risk of producing more new variants (see this preprint and this modeling data)
Researchers have from the start highlighted how unfair vaccine distribution is. So one important take home message from Omicron (even if it turns out not to be a serious variant that takes over Delta), should be that vaccine coverage has to increase rapidly on a global scale.
COVID-19 was just the other day detected in 61 (out of 600) passengers from South Africa to the Netherlands. It’s at this point uncertain how many who may have had the Omicron variant. If Omicron does spread as well as some think, then just in and around these few (now known/detected events), we should expect to also see many more cases (so this by itself will tell us how well Omicron may actually take over, and how well/poorly it may transmit). But while it does seem to keep spreading fast locally, we don’t yet know whether Omicron has higher transmisssibility per se. This was also highlighted in ECDC’s recent report, see quote below.
While there is some potentially reassuring data to indicate that at least some infected with the Omicron SARS-CoV-2 variant may primarily have mild symptoms, this may not tell the whole truth: if the cases one are observing are primarily in young individuals, this may bias the clinical presentation. Young individuals typically have milder COVID-19 symptoms, and are typically more often asymptomatic
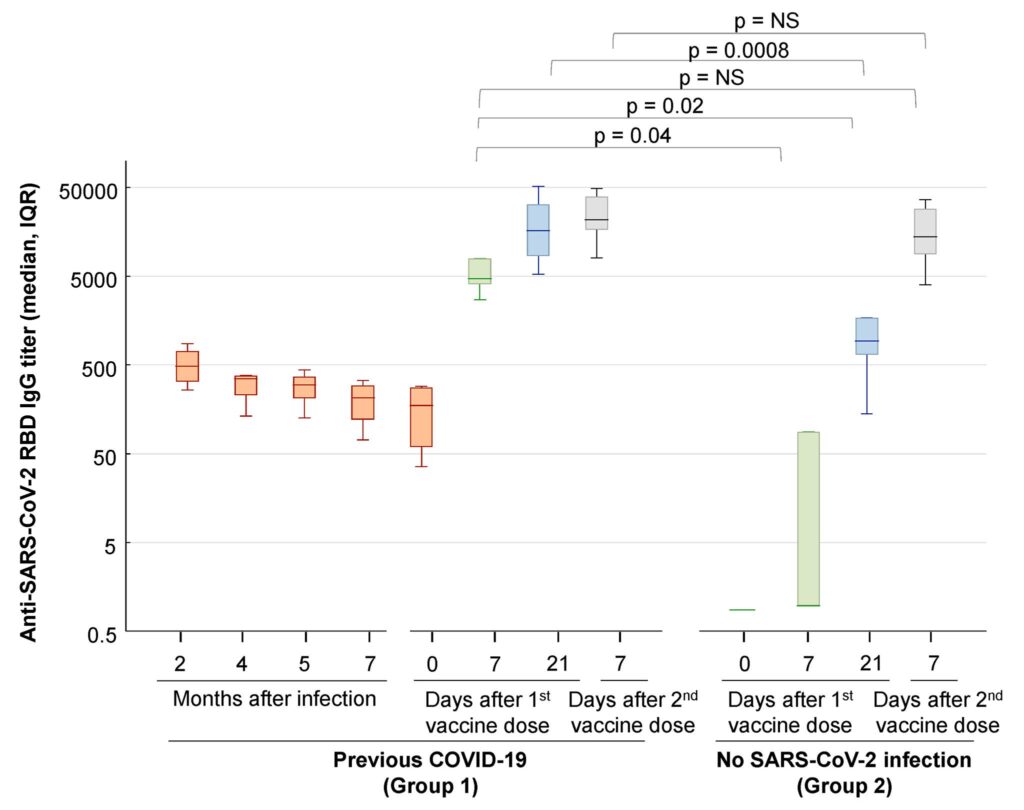
Other data indicates it may impact young individuals with moderate to severe disease, but also that this is primarily occurring in unvaccinated individuals, or in partially vaccinated individuals. In this context, it’s important to note that Gauteng only has ~38% fully vaccinated individuals (see the photo below); they’ve primarily used the Pfizer, AstraZeneca and J&J vaccines.
2. Potential impact of the Omicron variant on vaccine-mediated protection: many unknowns
Many researchers and epidemiologists think (of course they cannot know) that the vaccines will maintain either some or even high levels of protection (at least likely against severe disease – although with COVID-19, even mild disease is not to play around with, given the potential risk of long covid). That some level of protection should exist is more likely to be the case as many individuals (unfortunately not on a global scale) are able to get, or have already gotten, three vaccine doses.
This may be bit of a stretch, but that some protection should be maintained can potentially (note, not certain) be inferred from observations of how well the 3rd vaccine doses increase neutralization against other variants:
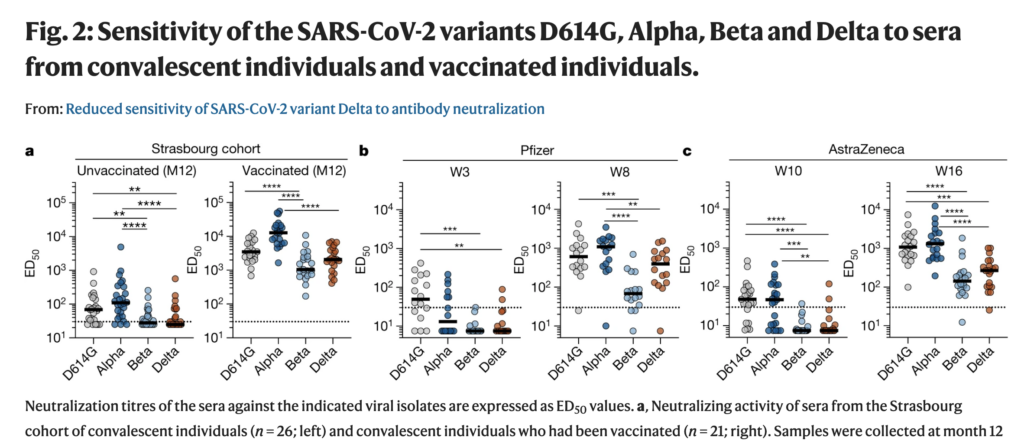
- A third dose (a “booster” dose) increases the neutralization by a factor of 15-32, against the beta variant (see this preprint of Moderna’s vaccine, and this based on Pfizer’s vaccine).
- The beta variant has previously been one of the most (if not the most) immunologically challenging variants that we have previously had circulating (or in other terms, it had a more significant degree of “immune escape”, compared with other SARS-CoV-2 variants).
- We now also know that even “only” two doses of e.g. Pfizer’s vaccine, protects quite well against at least severe COVID-19 caused by the beta variant of SARS-CoV-2 (Swedish summary)
At first glance, the list of mutations in Omicron looks quite overwhelming, especially if you just “name drop” them:
- A67V, Δ69-70, T95I, G142D, Δ143-145, Δ211, L212I, ins214EPE, G339D, S371L, S373P, S375F, K417N, N440K, G446S, S477N, T478K, E484A, Q493K, G496S, Q498R, N501Y, Y505H, T547K, D614G, H655Y, N679K, P681H, N764K, D796Y, N856K, Q954H, N969K, L981F) (see the following figure (from this Twitter thread) for a list of what the most important changes may be). Note that it has the mutation E484*A* – i.e. not E484K which the beta variant has/had, and which has been tied to some of the properties of the beta variant.
- 15 of these Spike protein mutations are located in the receptor binding domain (RBD) – to which at least some of the vaccine-induced antibodies bind; a domain that the virus uses to attach to cells (via the ACE2 receptor).

This list is long (32 spike mutations), but for context, we’ve had variants with almost as many mutations (25-29 mutations), and they didn’t spread well – even though they may have avoided the vaccines to a greater extent (but this didn’t become relevant, because of their poor spread). Nevertheless, the number of mutations are definitely a cause for concern and rapid in-lab assessment of the variant, according to many researchers.
There could very well be a founder effect with Omicron (that makes it seem that it spreads better than it actually does). Essentially at this point, there are many parameters that we don’t know yet, although multiple researchers do point out that this is perhaps the most challenging variant that we have seen so far (meaning *potentially* very challenging for our vaccines to neutralize, but this is again, still quite unknown at this point).
In terms of its transmissibility (which some prefer to refer to as the virus’ fitness), there are also many unknowns:
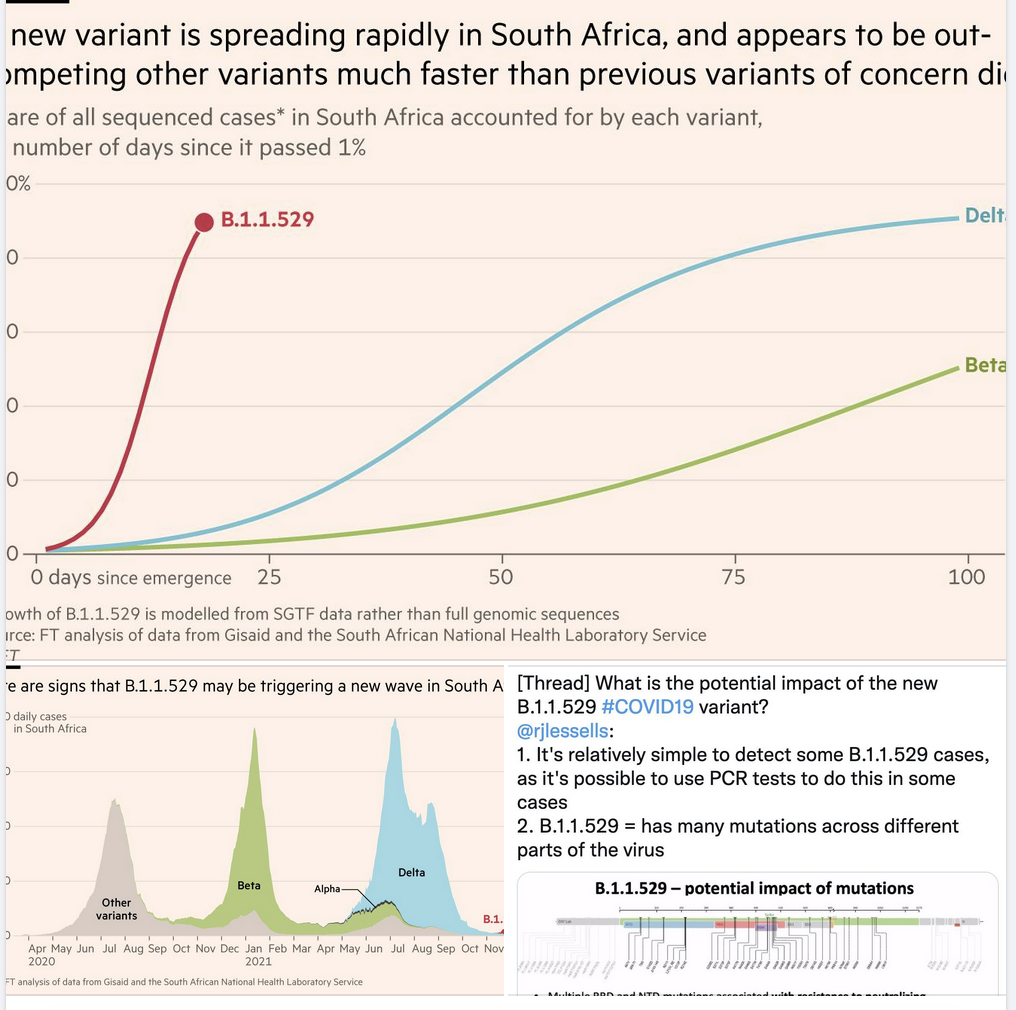
- While the rate of “takeover” has been very fast with Omicron (look at the larger, top figure below), it started from a point where community transmission was very low.
- This means that it would appear to spread well, but really be due to its spread in an overall, fairly low number of local COVID-19 cases (a founder effect). In such a setting, even “only” a slightly more transmissible variant could appear to “take over” (e.g. after a local superspreading event). See the lower left figure below.
- Its detection in multiple countries and places at this point, and some anecdotal cases, could potentially also indicate increased transmissibility. But it could also be the case that the variant has circulated for some time in these places (we will likely know more within a week or so, given that there are simple PCR-based methods for detecting this variant). The latter case, many argue, is another reason why outright travel bans do not serve a real purpose.
In their recent threat assessment brief for the Omicron variant, ECDC also highlighted these possibilities (including potential immune properties as a potential cause for increased spread):
- “The rapid pace of replacement of the Delta variant by Omicron in South Africa raises concerns that this variant is significantly more transmissible than Delta, however the overall COVID-19 case numbers in South Africa are currently low which could increase the proportional effect of any superspreading events involving a specific variant.
- In addition, the high observed growth rate could be due to immune escape. Further data are needed to be able to provide a reliable estimate of the transmissibility of the variant”
If vaccines do outright fail, we now have the technology and pipelines to update the vaccines within 100 days – because it’s still the same protein we would be targeting, just with some more changes
Moderna has already shown data one updated booster targeting a variant – the beta (B.1.351) variant – was safe and quite effective (at least in vitro; summary (Swedish summary)).
3. Omicron – another reason to get vaccinated, on a global scale
We don’t know how much, but variants like Omicron are, as also highlighted above, assessed as far likelier than any other prior variant to evade immune responses from prior COVID-19, or from vaccines.
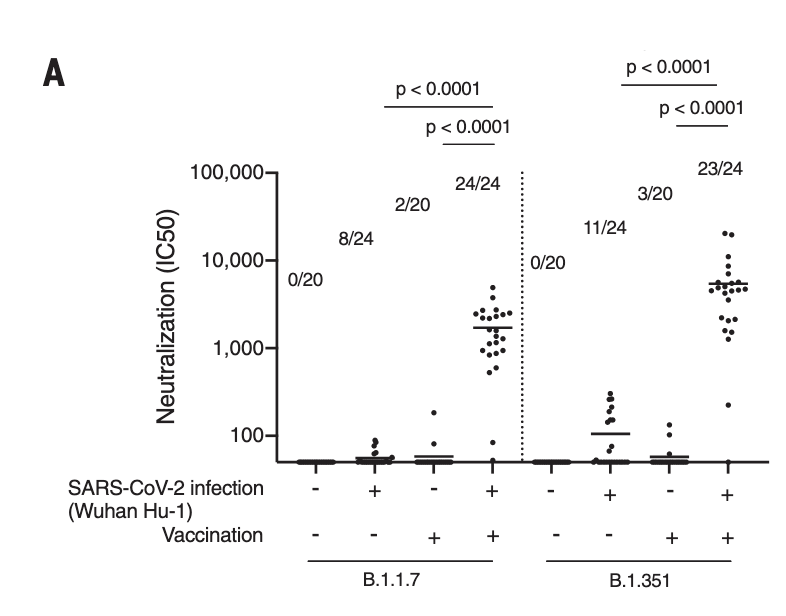
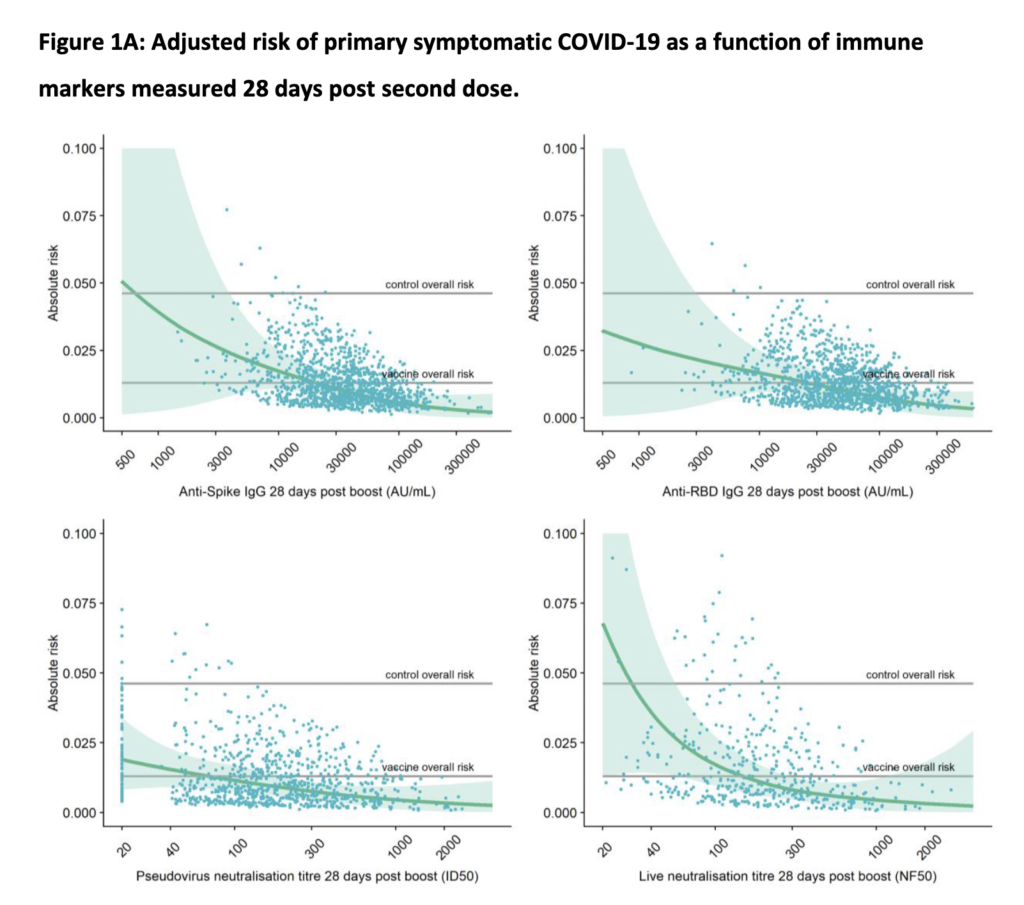
- In an in vitro-based study published in Nature, in the lab – under highly controlled conditions – they modified SARS-CoV-2 to generate a “polymutant” virus (a version that had 20 mutations that also occur naturally in SARS-CoV-2 variants across the globe; note that they used a pseudotypded virus, so not live SARS-CoV-2 virus, thus these results may not be totally applicable to real-life findings).
- What one of the researchers pointed out, is that Omicron has mutations in a lot of the regions of this modified SARS-CoV-2 in-lab version. This is noteworthy, as this modified in-lab virus version was able to evade neutralization by serum from all individuals who had *not* gotten vaccinated, but who had “only” recovered from COVID-19 (so-called convalescent individuals; i.e. they were using post-COVID-19 serum).
- However, in individuals who after COVID-19 *also* got vaccinated (the “ITV” group in the figure below), they still observed some maintained neutralization (meaning they should be able to neutralize the virus if they encounter it, at least to some degree).
- The COVID-19 with vaccine (ITV) group had a more sustained ability to neutralize this heavily mutated (in-lab) version of SARS-CoV-2 (this in-lab version was essentially tested to see how much a heavily mutated version of the virus would reduce our antibody-based immunity; once more an example of where science has been presciently helpful).
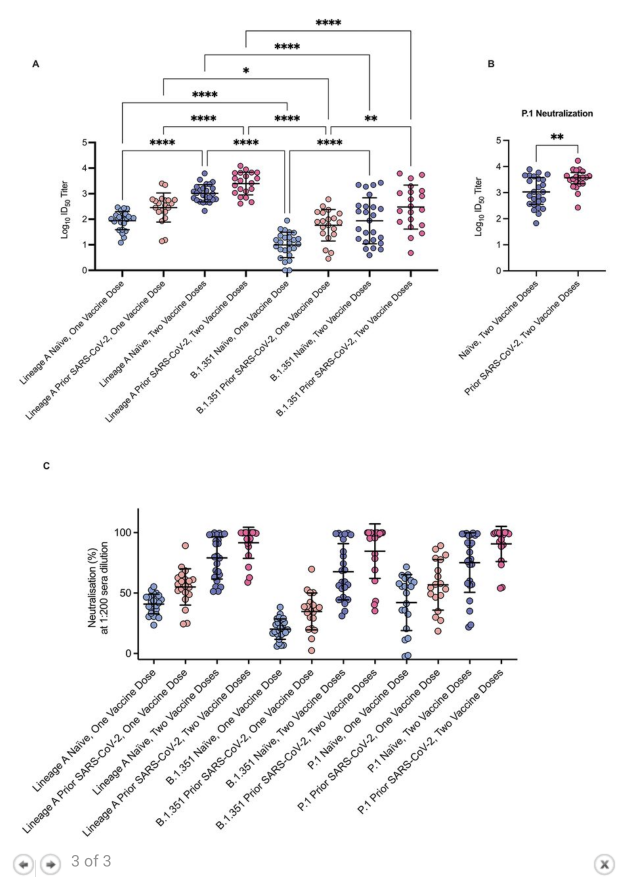
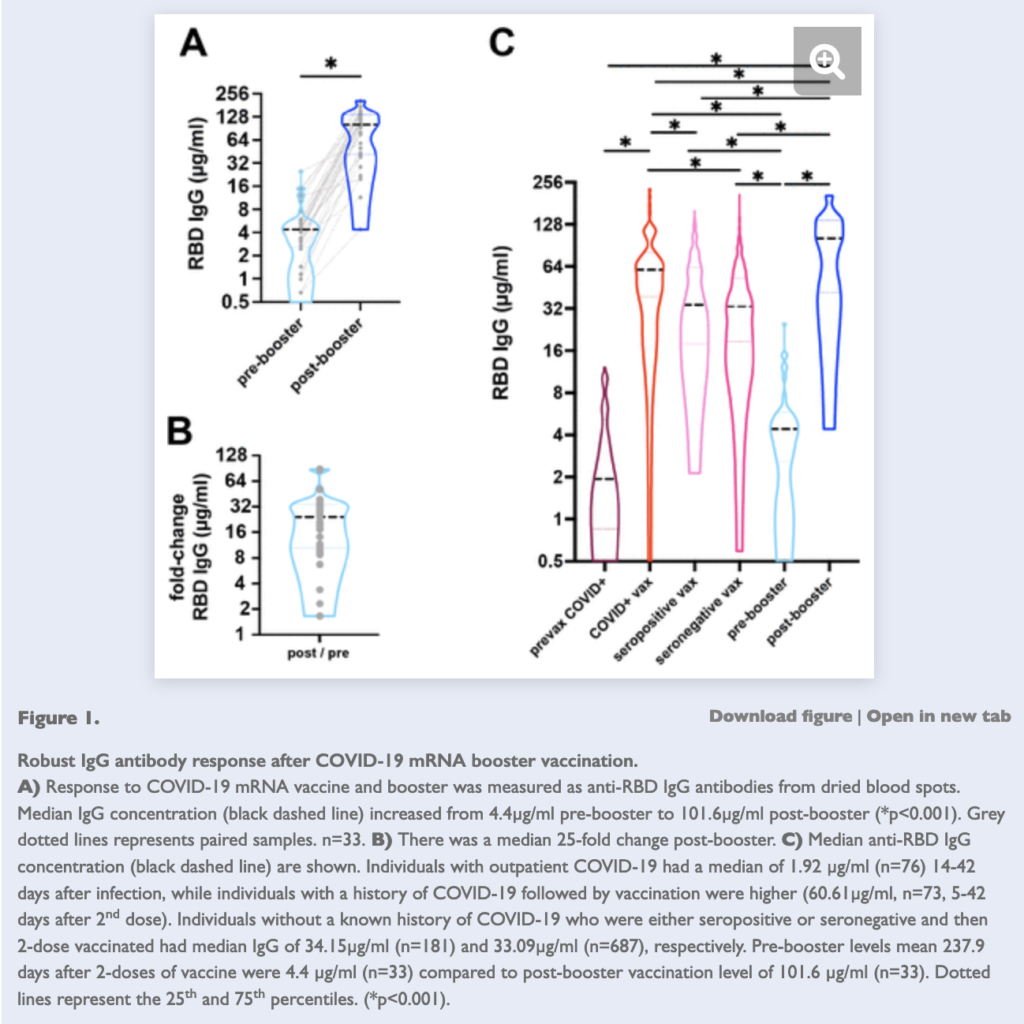
- And now we also have data from Northwestern University to show that those who get 3 doses of vaccines (e.g. 3 doses of Pfizer or Moderna), have even better antibody-based immunity than those who had COVID-19 and then got vaccinated (previously, COVID-19 followed by vaccination – or vice versa – was repeatedly found to provide the greatest degree of protection). See panel C from the screenshot below (the individuals who got a booster are shown in the blue part of the graph)
- Indeed, as indicated above, a 3rd dose of the vaccines boost antibody titers (as I’ve explained before) to complex variants, to a considerable degree (15–32x to the beta variant).
- One observation – just a report, not statistical data – that we have regarding the protective role of vaccination against the variant Omicron, is that moderate-to-severe cases in South Africa (a region that seems to have a lot of Omicron transmission), seem to primarily occur in unvaccinated or (to a lesser degree) in partially vaccinated individual.
So in sum: There are now more than reasons than ever to get vaccinated. If Omicron does transmit more easily, then it could put unvaccinated individuals at even greater risk, especially in places (like the northern hemisphere), where winter conditions are certain to increase the likelihood of greater spread of SARS-CoV-2 (because of colder weather, lower humidity and less time spent outdoors vs. indoors).
4. Hur man detekterar Omicron
Slutligen (här blir det svenska) kan man detektera B.1.1.529 (omicron) med TaqPath Assay:
- Liksom Alpha-varianten (B.1.1.7) så ger Omicron S gene target failure (SGTF), dvs. pga. en deletion i Spike-proteinet, som gör att man får negativ signal för en av proberna. Denna deletion hade även Alpha-varianten (B.1.1.7) av SARS-CoV-2-viruset.
- I sin rapport beskriver ECDC att bland 77 selekterade SGTF-prover som sekvenserades (från Gauteng i Sydafrika), så var alla Omicron (dvs. belyser att den PCR-baserade metoden tycks finna samtliga fall av denna variant; eftersom Alpha inte längre sprids).
5. ECDC:s bedömning
Oavsett vad jag skrivit ovan finns det redan en helt färsk riskbedömning från ECDC, där de bedömer risken med denna variant B.1.1.529 / Omicron som hög till mycket hög (high to very high).
- De påpekar bland annat osäkerheten gällande vaccinens verkan, liksom avseende risken för reinfektioner.
- De bedömer att risken för spridning i en delta-rik miljö är hög
- Därtill bedömer de att inverkan av omicron [på samhällsnivå] skulle kunna vara mycket hög, om den sprids när delta är på uppgång (t.ex. pga. säsongsberoende faktorer eller lättade samhällsåtgärder, som sammantaget påskyndar samhällsspridningen).
Finally, once more, please note that everything regarding this variant is still very preliminary. Many of the observations above may be old news or outdated within a few days to weeks from now.
Med vänliga hälsningar,
Jonathan Cedernaes
Leg. läkare, PhD och senior forskare